
【题目】我国对“可呼吸”的钠——二氧化碳电池的研究取得突破性进展。该电池的总反应式为4Na+3CO2![]() 2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
2Na2CO3+C,其工作原理如图所示(放电时产生的Na2CO3固体贮存于碳纳米管中)。
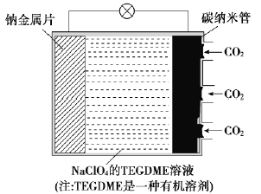
(1)钠金属片作为该电池的___极(填“正”或“负”,下同);放电时,电解质溶液中Na+从___极区向___极区移动。
(2)充电时,碳纳米管连接直流电源的___极,电极反应式为___。
【答案】负 负 正 正 2Na2CO3+C-4e-=3CO2↑+4Na+
【解析】
(1)从电池总反应4Na+3CO2![]() 2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中阳离子向正极区移动。
2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中阳离子向正极区移动。
(2)充电时,负极连接直流电源的负极,正极连接直流电源的正极,电极反应式为作原电池正极时反应的逆反应。
(1)从电池总反应4Na+3CO2![]() 2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中Na+(阳离子)从负极区向正极区移动。答案为:负;负;正;
2Na2CO3+C可以看出,Na由0价升高到+1价,则钠金属片失电子,作为该电池的负极;放电时,电解质溶液中Na+(阳离子)从负极区向正极区移动。答案为:负;负;正;
(2)充电时,负极(钠金属片)连接直流电源的负极,碳纳米管(正极)连接直流电源的正极,电极反应式为2Na2CO3+C-4e-=3CO2↑+4Na+。答案为:正;2Na2CO3+C-4e-=3CO2↑+4Na+。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存放置于低温处
D.实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如下转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为C9H10O2,试回答下列有关问题。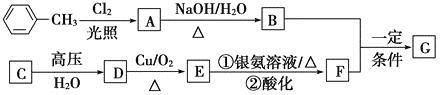
(1)G的结构简式为_______________________________。
(2)指出下列反应的反应类型:A转化为B:__________________,C转化为D:______________________。
(3)写出下列反应的化学方程式:
D生成E的化学方程式:________________________________。
B和F生成G的化学方程式:___________________________。
(4)符合下列条件的G的同分异构体有________种。
①苯环上有3个取代基,且有两个取代基相同;②能够与新制的银氨溶液反应产生光亮的银镜。其中共有四种不同化学环境氢原子的同分异构体的结构简式为_____________、____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+O2(g)![]() 2NO(g) ΔH=+181.5kJ·mol-1。某科研小组尝试利用固体表面催化工艺进行NO的分解,若用
2NO(g) ΔH=+181.5kJ·mol-1。某科研小组尝试利用固体表面催化工艺进行NO的分解,若用![]() 分别表示O2、N2、NO,则在固体催化剂表面分解NO的过程可用如图表示,下列说法正确的是( )
分别表示O2、N2、NO,则在固体催化剂表面分解NO的过程可用如图表示,下列说法正确的是( )

A.从吸附到解吸的过程中,能量状态最低的是C处
B.图示过程中,反应物断键吸收能量大于生成物形成新键释放的能量
C.该反应中NO分子浓度越大,分解速率越快
D.该反应中的固体催化剂起到反应载体的作用,未影响反应的速率,并且该反应的ΔH也不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,充分搅拌后静置,最终所得晶体(Na2CO310H2O)的质量 ( )
A. 等于1.06g B. 大于1.06g而小于2.86g C. 等于2.86g D. 大于2.86g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次硫酸钠甲醛(xNaHSO2yHCHOzH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:①准确称取1.5400g样品,完全溶于水配成100mL溶液。②取25.00mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10mol×L-1。③另取25.00mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。次硫酸氢钠和碘反应的方程式如下:xNaHSO2yHCHOzH2O+I2→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.5825g白色固体时,需要消耗碘的质量为_____。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式_____。
(3)通过计算确定次硫酸氢钠甲醛的组成______(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入CO和![]() 各
各![]() mol,一定温度下发生反应:
mol,一定温度下发生反应:![]() ,下列叙述正确的是
,下列叙述正确的是
A.如果容器内压强不再改变,则证明该反应已达到平衡状态
B.寻找合适的催化剂是加快反应速率并提高![]() 产率的有效措施
产率的有效措施
C.当反应达到平衡后,保持容器内体积不变,再向其中充入CO和![]() 各1mol,达到新的平衡后
各1mol,达到新的平衡后![]() 的产率会增大
的产率会增大
D.如果在某温度下平衡常数为![]() ,则平衡时CO转化率为
,则平衡时CO转化率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)置于一恒容密闭容器中,在不同温度下进行反应(已知该反应为放热反应)。实验记录得到下表中的两组数据:下列有关说法中不正确的是( )
实验序号 | 温度(℃) | 平衡常数(L/mol) | 起始量/mol | 平衡量/mol | 达到平衡所需时间(min) | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. 表中x=1.6;y=0.2B. 表中t>6
C. 表中K1、K2的关系:K2>K1D. 实验1在前6min的反应速率υ(SO2)=0.2mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知: C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)===CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)===H2O(g)+CO2(g),ΔH= _____________kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
①下列情形不能说明该反应已达到平衡状态的是_________(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如上图所示。A、B两点的平衡常数KA_______KB(填“>”、“=”或“<”,下同);由图判断ΔH ______0。
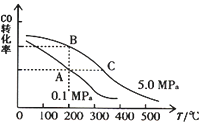
(3)某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25 mol/L,则此温度下的平衡常数K=_________(保留二位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com