
分析 A+、B2+、C-、D2-的电子层结构与氩原子相同,即A失去1个电子后为18电子,B失去2个电子后为18电子,C原子得到1个电子后为18电子,D原子得到2个电子后为18电子,则A、B、C、D四种元素分别是A是K,B是Ca,C是Cl,D元素为S元素,然后根据非金属性越强对应单质的氧化性越强,金属性越强对应单质的还原性越强,微粒半径的比较根据电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,分析解答.
解答 解:A+、B2+、C-、D2-的电子层结构与氩原子相同,即A失去1个电子后为18电子,B失去2个电子后为18电子,C原子得到1个电子后为18电子,D原子得到2个电子后为18电子,则A、B、C、D四种元素分别是A是K,B是Ca,C是Cl,D元素为S元素;元素非金属性越强,对应单质的氧化性越强,C与D单质的氧化性强弱顺序是Cl2>S,金属性越强对应单质的还原性越强,还原性强弱顺序是K>Ca,电子层数越多半径越大,电子层数相同时核电荷数越多半径越小,所以原子半径由到小的顺序是K>Ca>S>Cl,四种离子的离子半径由大小的顺序是S2->Cl->K+>Ca2+,故答案为:Cl2>S;K>Ca;K>Ca>S>Cl;S2->Cl->K+>Ca2+.
点评 本题考查元素周期律的相关和微粒半径大小的比较,学生要清楚半径大小的比较要根据三比较的先后左右顺序进行,先比较电子层,再比较核电荷,最后比较最外层电子数,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 烃是指仅含碳和氢两种元素的有机物 | |
| B. | 含碳化合物都属有机物 | |
| C. | 分子里含有苯环的碳氢化合物属于芳香烃 | |
| D. | 通常所说的“白色污染”是指聚乙烯等白色塑料垃圾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,工业合成路线如下:
,工业合成路线如下:

 (R-代表烃基)
(R-代表烃基) 、
、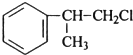 ;
;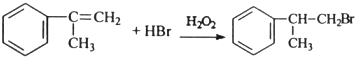 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CO | H2 | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0.18 |
| Ⅱ | T1 | 0.4 | 0.8 | |
| Ⅲ | T2 | 0.2 | 0.4 | 0.16 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大 | |
| C. | 采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率 | |
| D. | 若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
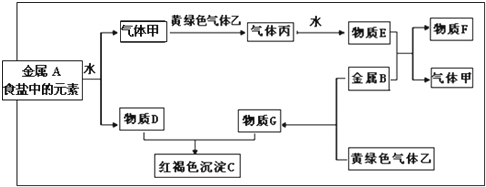
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;C 单质在高温下与B单质充分反应所得化合物的电子式为
;C 单质在高温下与B单质充分反应所得化合物的电子式为
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
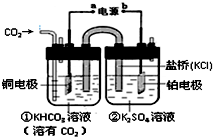
| A. | 该装置为原电池,其中a为正极 | |
| B. | 铜电极的电极反应式为:CO2+8H++8e-$?_{加热}^{催化剂}$CH4+2H2O | |
| C. | 反应开始后,电子从a极流出至铜电极,经电解质溶液到铂电极最后流回至b极 | |
| D. | 一段时间后,②池中溶液的pH一定下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,最高价氧化物的化学式为:Cl2O7.
,最高价氧化物的化学式为:Cl2O7. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在某淀粉溶液中加入适量的稀硫酸,并加热一段时间,待冷却后,再加入银氨溶液来检验淀粉是否已发生水解 | |
| B. | 把R-X与NaOH水溶液混合,加入硝酸银溶液来验证R-X是否为碘代烷 | |
| C. | 在三颈烧瓶中先加入少量铁粉,再加入5mL苯和1mL液溴的混合物,待充分反应后可制得少量溴苯 | |
| D. | 将无水乙醇和浓硫酸共热至140℃可制得乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com