
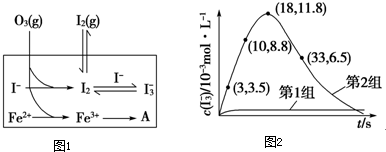
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2+ | 5.2 | 4.1 |
| △c |
| △t |
| c(I 3 -) |
| c(I 2)c(I -) |
| c(I 3 -) |
| c(I 2)c(I -) |
| 11.8×10 -3mol/L-3.5×10 -3mol/L |
| 15S |


科目:高中化学 来源: 题型:
| 选项 | 条件 | 粒子组 | 评价 |
| A | 含FeCl2的溶液中. | H+、H202、Cl- | 会发生反应,所以不能大量共存 |
| B | 室温时,pH=11的溶液中 | Na+、ClO-、AlO2- | 能大量共存 |
C | 水电离的c(H+)=1×10-10mol/L 的溶液中 | Al3+、NH4+、NO3- | 可能大量共存 |
| D | 某无色溶液中 | Na+、HC03-、OH-. | 会产生C02,所以不能大量共存 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
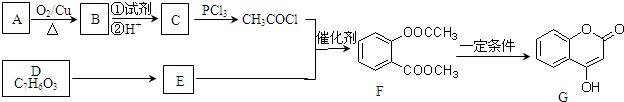
| PCl3 |
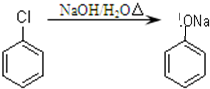 )制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯(
)制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯(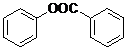 )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
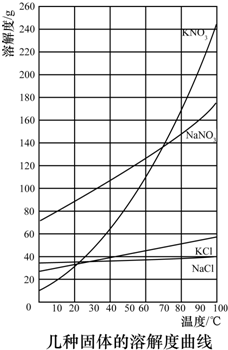
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+):c(OH-)=1:10-2的溶液中K+、Ba2+、ClO-、CO32-一定能大量存在 | ||
| B、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | ||
C、往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中
| ||
| D、等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3⑤NH4HCO3中c(CO32-)的大小关系为:②>④>③>⑤>① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、CH3COONa和CH3COOH混合溶液一定存在:c(Na+)=c(CH3COO-)=c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
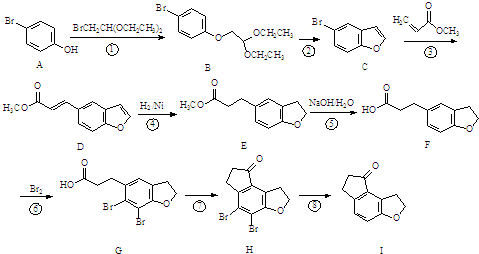
| PDC/DMF |
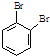 为原料,合成
为原料,合成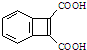 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成| HBr |
| NaOH溶液 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
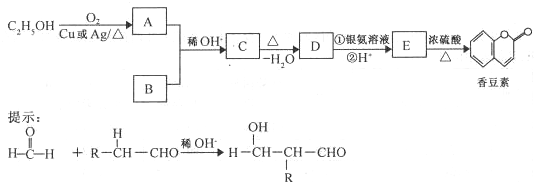
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com