
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )
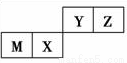
A. 原子半径Z<M
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期、第ⅥA族
科目:高中化学 来源:2017届河北省邯郸市高三上学期第一次月考化学试卷(解析版) 题型:实验题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-===5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显血红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显血红色,该红色物质是______(用化学式表示);CCl4中显紫红色的物质是______(用电子式表示)。
②第二份试剂中加入足量KI固体后,反应的离子方程式为__________________。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式:__________________。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?____(填“是”或“否”),并说明理由:_________________________。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是
________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂。请设计实验方案,检验该加碘盐中的Fe2+:________________________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省安康市高三上学期第一次月考化学试卷(解析版) 题型:实验题
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
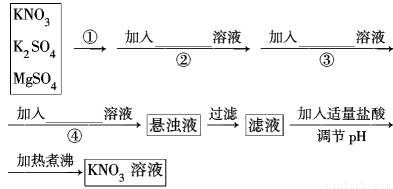
(1)操作①为_________________________。
(2)操作②~④加入的试剂依次可以为:______________________________
(3)如何判断SO42-已除尽? _
(4)实验过程中产生的多次沉淀________(填“需要”或“不需要”)多次过滤,其理由是______________
(5)该同学的实验设计方案是否严密?请说明理由:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省安康市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关仪器使用方法或实验操作正确的是( )
A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B. 酸式滴定管装标准溶液前,必须先用该溶液润洗
C. 酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D. 所有玻璃仪器加热时均需垫石棉网
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上学期开学考试化学试卷(解析版) 题型:实验题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
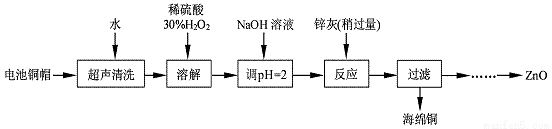
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式: ;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 ;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 | 1 | 2 | 3[ | 4 |
V(Na2S2O3)(mL) | 28.32 | 25.31 | 25.30 | 25.32 |
计算电池铜帽中Cu的质量分数为 ,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会 (填“偏高”、“偏低”或“无影响”);
(3)常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3,计算沉淀生成后溶液中c(Cu2+)= mol/L;
(4)已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH | 沉淀完全的pH | |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 5.9 | 8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2,使其充分反应;
② ;③过滤;
④ ;⑤过滤、洗涤、干燥;⑥900℃煅烧。
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上学期开学考试化学试卷(解析版) 题型:选择题
下列各项叙述正确的是( )
A. 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B. 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C. 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D. 24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期暑假联考化学试卷(解析版) 题型:填空题
我国产铜主要取自黄铜矿(CuFeS2),随着矿石品味的降低和环保要求的提高,湿法炼铜的优势日益突出。该工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为 。
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为 。
Ⅱ.配位浸出
反应原理为: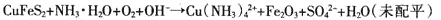
(2)为提高黄铜矿的浸出率,可采取的措施有 (至少写出两点)。
(3)为稳定浸出液的pH,生产中需要向氨水中添加NH4C1,构成NH3·H2O-NH4Cl缓冲溶液。某小组在实验室对该缓冲体系进行了研究:25℃时,向amol·L-l的氨水中缓慢加入等体积0.02 mol·L-l的NH4C1溶液,平衡时溶液呈中性。则NH3·H2O的电离常数Kb= (用含a的代数式表示);滴加NH4C1溶液的过程中水的电离平衡 (填“正向”、“逆向”或“不”)移动。
Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
(4)在微生物的作用下,可以循环使用的物质有 (填化学式),微生物参与的离子反应方程式为____ (任写一个)。
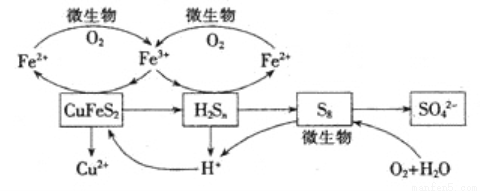
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期暑假联考化学试卷(解析版) 题型:选择题
除去下列物质中所含的杂质,选用的试剂正确的是
选项 | 物质(杂质) | 试剂 |
A | Al2O3(SiO2) | NaOH溶液 |
B | FeCl2溶液(FeCl3) | Fe粉 |
C | CO2(SO2) | Na2CO3溶液 |
D | NaHCO3溶液(Na2CO3) | Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高二(下)期末化学试卷(解析版) 题型:实验题
氢化阿托醛(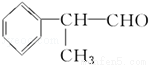 )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下:
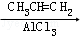

 [A]
[A]
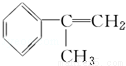

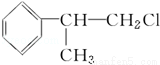
 [D](Mr=136)
[D](Mr=136)
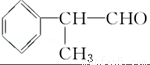
(1)在合成路线上①~⑤反应中,属于消去反应的为 (填反应序号).
(2)写出反应③、④的化学方程式: .
(3)在一定条件下,D与有机物X发生酯化反应生成E(Mr=164),则X的结构简式为 ,
写出满足下述两个条件的E的两种同分异构体的结构简式: .
a.属于羧酸 b.苯环上的一氯取代物只有一种结构.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com