
下列装置所示的实验,能达到实验目的是()
A. 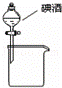
分离碘酒中的碘和酒精 B. 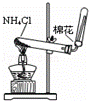
实验室制氨气
C. 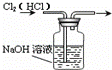
除去Cl2中的HCl D. 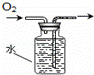
排水集气法收集O2
考点: 化学实验方案的评价.
专题: 实验评价题.
分析: A.互不相溶的液体采用分液方法分离;
B.氯化铵不稳定,加热易分解生成氨气和HCl,但冷却时HCl和氨气反应生成氯化铵;
C.Cl2、HCl都可以和NaOH溶液反应;
D.用排水法收集氧气时,导气管遵循“短进长出”原则.
解答: 解:A.碘易溶于乙醇,所以二者不分层,应该采用蒸馏方法分离,故A错误;
B.氯化铵不稳定,加热易分解生成氨气和HCl,但冷却时HCl和氨气反应生成氯化铵,所以不能采用加热氯化铵的方法制取氨气,可以采用加热NH4Cl和Ca(OH)2的方法制取NH3,故B错误;
C.Cl2、HCl都可以和NaOH溶液反应,所以不能用NaOH溶液除去Cl2中的HCl,应该用饱和食盐水除去Cl2中的HCl,故C错误;
D.用排水法收集氧气时,导气管遵循“短进长出”原则,所以该装置符合排水法收集氧气操作,故D正确;
故选D.
点评: 本题考查化学实验方案评价,侧重对实验原理、基本操作的考查,知道常见混合物提纯和分离方法、常见气体的制取和收集等知识点即可解答,会从基本操作的规范性、物质的性质、实验原理进行评价,题目难度中等.


科目:高中化学 来源: 题型:
某溶液中可能含有大量下列阴离子:OH﹣、SO42﹣、CO32﹣、Cl﹣.
(1)当溶液中存在大量H+时,则溶液中不可能有大量的 .
当溶液中有大量的Ba2+存在时,则溶液中不可能有大量的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在溶液中可发生以下反应:①H++Z﹣+XO4﹣=X2++Z2+H2O(未配平),②2M2++R2=2M3++2R﹣,③2R﹣+Z2=R2+2Z﹣,由此判断下列说法正确的是()
A. 常温下反应2M2++Z2=2M3++2Z﹣不可以自发进行
B. R元素在反应②中被氧化,在③中被还原
C. 反应①配平后,H2O的化学计量数为8
D. 还原性强弱顺序为:X2+>Z﹣>R﹣>M2+
查看答案和解析>>
科目:高中化学 来源: 题型:
I.下列物质中属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 .(填序号) ①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O.已知K2S2O8的氧化性比K2Cr2O7强.
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是 是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
Li~SO2电池具有输出功率高且低温性能好特点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动.电池总反应式为:2Li+2SO2 Li2S2O4下列有关电池的说法正确的是()
Li2S2O4下列有关电池的说法正确的是()
A. 该电池总反应为可逆反应
B. 充电时阴极反应式为:Li++e﹣═Li
C. 放电时Li+向负极移动
D. 该电池电解质溶液可换成LiBr水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
已知碳碳单键可以绕键轴自由旋转,结构简式为: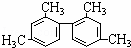 的烃,下列说法正确的是()
的烃,下列说法正确的是()
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①标准状况下,22.4L己烯含有的分子数为NA
②标准状况下,22.4L氧气和氮气的混合物含有的分子数约为NA
③7.1g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2NA
④1mol氨气中含有的共价键数约为4NA
⑤500mL1mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5NA.
A. ①④ B. ②⑤ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,pH=5的NH4Cl溶液中,由水电离出的OH﹣浓度是()
A. 1×10﹣5mol/L B. 1×10﹣7mol/L C. 1×10﹣9mol/L D. 1×10﹣14mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com