
����Ŀ��X��Y��Z��W��R��Ԫ�����ڱ�ǰ������Ԫ���е����ֳ���Ԫ�أ���ԭ��������������X�Ļ�̬ԭ�ӵ����������Ų�ʽΪnsnnpn+1 �� Y��Zͬ������ZY2�ǵ����������Ҫ����֮һ��Rλ��ds����ԭ�������ֻ��һ�����ӣ�Wԭ�Ӵ���������Ϊ������������7������ش��������⣺
��1��Wλ��Ԫ�����ڱ��������壬���̬ԭ�ӵĺ�������Ų�ʽΪ ��
��2��Y����̬�⻯����ȶ��Ա�Z����̬�⻯����ȶ������ǿ������������Y�ĵ�һ�����ܱ�Z�������С������
��3��X���������̬�⻯����ӵ�VSEPRģ��Ϊ �� ���ӵĿռ乹���� ��
��4��ԭ��������ͬ���۵���������ͬ�ķ��ӻ����ӳ�Ϊ�ȵ����壮�ֱ�д��һ����X02����Ϊ�ȵ�����ĵ��ʺͻ�����Ļ�ѧʽ���� �� XO2��������ԭ�Ӳ����ӻ���
��5��[W��CN��6]3��������W����������CN��֮��Ĺ��ۼ���Ϊ �� �û�ѧ���ܹ��γɵ�ԭ���� ��
��6��ͼ��R����ľ����ṹʾ��ͼ��ÿ�������к�����Rԭ�ӣ� 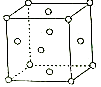
���𰸡�
��1���ģ�����1s22s22p63s23p63d64s2
��2��ǿ��С
��3�������壻������
��4��O3��SO2��sp2
��5����λ����Fe3+�����пչ����CN�������й¶Ե���
��6��4
���������⣺X��Y��Z��W��R��Ԫ�����ڱ�ǰ������Ԫ���е����ֳ���Ԫ�أ���ԭ��������������X�Ļ�̬ԭ�ӵ����������Ų�ʽΪnsnnpn+1 �� s�ܼ�����2�����ӣ���n=2����XΪNԪ�أ�Y��Zͬ������ZY2�ǵ����������Ҫ����֮һ����YΪOԪ�ء�ZΪSԪ�أ�Rλ��ds����ԭ�������ֻ��һ�����ӣ���Χ�����Ų�ʽΪ3d104s1 �� ��RΪCu��Wԭ�Ӵ���������Ϊ������������7����ԭ����������S��С��Cu��ֻ�ܴ��ڵ������ڣ�����������Ϊ2������������Ϊ14����������Ų�ʽΪ1s22s22p63s23p63d64s2 �� ��WΪFe����1��WΪFeԪ�أ�λ��Ԫ�����ڱ��������ڢ��壬���̬ԭ�ӵĺ�������Ų�ʽΪ1s22s22p63s23p63d64s2 �� ���Դ��ǣ��ģ�����1s22s22p63s23p63d64s2����2���ǽ�����O��S�����⻯���ȶ���H2O��H2S��ͬ�������϶���Ԫ�ص�һ�����ܼ�С�����һ������O��S�����Դ��ǣ�ǿ��С����3��X���������̬�⻯��ΪNH3 �� Nԭ���γ�3��N��H��������1�Թ¶Ե��ӣ��۲���Ӷ���Ϊ4�����ӵ�VSEPRģ��Ϊ�����壬���ӵĿռ乹���������Σ����Դ��ǣ������壻�����Σ���4����NO2����Ϊ�ȵ�����ĵ��ʺͻ�����Ļ�ѧʽ��O3��SO2 �� NO2����Nԭ�Ӽ۲���Ӷ���=2+ ![]() =3��Nԭ�Ӳ�ȡsp2�ӻ������Դ��ǣ�O3��SO2��sp2����5��[Fe��CN��6]3����������������CN��֮��Ĺ��ۼ���Ϊ��λ�����û�ѧ���ܹ��γɵ�ԭ���ǣ�Fe3+�����пչ����CN�������й¶Ե��ӣ����Դ��ǣ���λ����Fe3+�����пչ����CN�������й¶Ե��ӣ���6��R�����ÿ�������к���Rԭ����ĿΪ8��
=3��Nԭ�Ӳ�ȡsp2�ӻ������Դ��ǣ�O3��SO2��sp2����5��[Fe��CN��6]3����������������CN��֮��Ĺ��ۼ���Ϊ��λ�����û�ѧ���ܹ��γɵ�ԭ���ǣ�Fe3+�����пչ����CN�������й¶Ե��ӣ����Դ��ǣ���λ����Fe3+�����пչ����CN�������й¶Ե��ӣ���6��R�����ÿ�������к���Rԭ����ĿΪ8�� ![]() +6��
+6�� ![]() =4�����Դ��ǣ�4��
=4�����Դ��ǣ�4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�ȼ�յ����ʵ��������и������ʣ�������������������ȵ��ǣ� �� ��C2H2��C2H4O ��C4H8��C6H12O6��C7H8��C6H12��HCOOCH3��CH3COOH��
A.�٢ۢ�
B.�٢ڢۢ�
C.�٢�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��֬��Ӧ�ù㷺�ĸ߷��Ӳ��ϣ����÷�����ȩ��������Ĵ�������϶��ɣ����Ƶĺϳɹ����磺 ��Ӧ�� 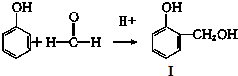
��Ӧ�� 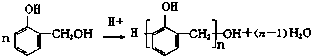
��1���������ķ���ʽ ��
��2��������Ũ��ˮ��Ӧ�Ļ�ѧ����ʽΪ ��
��3��������� 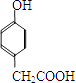 Ҳ����CH3CHO�������Ʒ�Ӧ�ٵķ�Ӧ�������л���÷�Ӧ��ѧ����ʽΪ�� �л���������Ʒ�Ӧ�ڵķ�Ӧ�����ɸ߷��ӻ�������Ľṹ��ʽΪ ��
Ҳ����CH3CHO�������Ʒ�Ӧ�ٵķ�Ӧ�������л���÷�Ӧ��ѧ����ʽΪ�� �л���������Ʒ�Ӧ�ڵķ�Ӧ�����ɸ߷��ӻ�������Ľṹ��ʽΪ ��
��4���йػ������͢��˵����ȷ����������ĸ��
A.�����ڷ�����
B.������FeCl3��Һ������ɫ��Ӧ
C.������NaHCO3��Һ��Ӧ�ų�CO2
D.1mol�Ģ�������2mol��NaOH��ȫ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��Ӻ�����������ԭ��VSEPRģ��Ϊ�������Σ��ҷ��ӻ����ӿռ�Ĺ���ΪV�ε��ǣ� ��
A.NH4+
B.PH3
C.H3O+
D.OF2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��Mg3N2����һ�ֻ���ɫ��ĩ�����������������մɲ��ϡ������ȣ����ɽ���þ�ʹ����ĵ�����Ӧ�Ƶã�ij��ѧ��ȤС��ͬѧ������ͼ��ʾװ�����Ʊ�������Mg3N2 �� 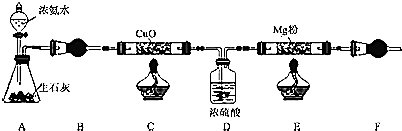
��֪Mg3N2����ˮ��Ӧ���йط�Ӧ����ʽΪMg3N2+6H2O�T3Mg��OH��2��+2NH3����
�ش��������⣺
��1��װ��A�з�Ӧ����������Ϊ ��
��2��װ��B�е��Լ�Ϊ �� װ��F�������� ��
��3��װ��C��E����Ҫ���ȣ�Ӧ�ȼ��� �� ������ ��
��4��װ��C�е������Ǻ�ɫ������ͭ��죬�йط�Ӧ�Ļ�ѧ����ʽΪ ��
��5����C��NH3��ת���ʲ��ߣ��ײ����������� �� ��������� ��
��6����ʵ�������װ��E�й���ȫ��ȡ��������Ϊag�����������μ���������ϡ�����NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�������ó���bg�����Ʒ�е���þ����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ����У������ɽ���������ֱ�ӷ�Ӧ�Ƶã������ɽ��������ᷴӦ�Ƶõ��ǣ� ��
A.CuCl2B.FeCl2C.AlCl3D.FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20 g A���ʺ�14 g B����ǡ����ȫ��Ӧ������8.8 g C���ʡ�3.6 g D���ʺ�0.2 mol E���ʣ���E���ʵ�Ħ������Ϊ(����)
A. 100 g/mol B. 108 g/mol C. 55 g/mol D. 96 g/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com