
肼(N2H4)是火箭发射常用的燃料。
(1)最新实验研究用肼还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。请写出该制法的化学反应方程式____________________________,当反应中转移0.2 mol电子 时,可制得Cu2O的质量为__________。
(2)一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。负极上发生的电极反应为_________________; ②电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。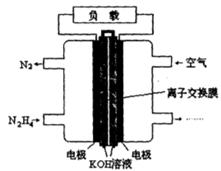
(1)N2H4+4Cu(OH)2= 2Cu2O+N2+6H2O 14.4g
(2)①N2H4+4OH--4e-=N2+4H2O ② 右侧 左侧
解析试题分析:(1)根据题意可知该反应的方程式为:N2H4+4Cu(OH)2="==" 2Cu2O+N2+6H2O。每产生2摩尔的Cu2O,转移电子4NA。当反应中转移0.2 mol电子时,可制得Cu2O 0.1mol,其质量为0.1mol×144g/mol =14.4g.
(2)根据题意可知:在该肼(N2H4)为燃料的电池中,通入肼(N2H4)的电极为负极,通入空气的电极正极。负极的电极反应式为:N2H4+4OH--4e-="==" N2+4H2O,电池工作时电子由负极经过负载到正极,产生的电流则从右侧的电极经过负载后流向左侧的负极。
考点:考查火箭发射常用的燃料肼(N2H4)的性质及在燃料的电池应用的知识。


科目:高中化学 来源: 题型:填空题
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是________________。
(3)把KI换成KBr,则CCl4层变成________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(4)加碘盐中含碘量为25.4mg~50 mg/kg。制取加碘盐(含KIO3的食盐)1000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素十分重要,其单质及其化合物在科研、生产领域有着十分广泛的用途。
(1)氮元素核外电子排布式为: ,原子核外共有 种不同能级的电子,氮原子核外电子云有 种不同的伸展方向,有 种不同运动状态的电子。
(2)最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:
2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动
D.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中进行,当反应达到平衡后,下列判断错误的是
A.容器中气体的平均分子量不随时间而变化 B.通入大量稀有气体能提高反应的速率
C.容器中气体的密度不随时间而变化 D.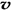 (N2)/
(N2)/ 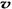 (O2)=2:3
(O2)=2:3
(4)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解,反应的化学方程式4NH4ClO4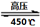 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学反应的反应物和产物如下:Al+NaNO3+H2O Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是______________。
(2)该反应的氧化产物是_______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积________L。
(4)配平该反应的化学方程式:
______Al+_____NaNO3+_____H2O==______Al(OH)3+______N2+______NaAlO2。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在下列反应中:
| A.2F2+2H2O=4HF+O2↑; | B.2Na+2H2O=2NaOH +H2↑; | C.CaO+H2O=Ca(OH)2; | D.2H2O 2H2↑+O2↑。其中(填序号): 2H2↑+O2↑。其中(填序号): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是 ;转移电子的物质的量为 mol。
(2)反应后,若产生14g N2,则有 g NH3被氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。关于双氧水,回答下列问题:
| A.Na2O2 + 2HCl =" 2NaCl" + H2O2 |
| B.Ag2O + H2O2 =" 2Ag" + O2↑ + H2O |
| C.2H2O2 = 2H2O + O2↑ |
| D.3H2O2 + Cr2(SO4)3 + 10KOH = 2K2CrO4 + 3K2SO4 + 8H2O |

| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,_______是氧化剂;_______是还原剂;_______元素被氧化;_______元素被还原;______是氧化产物;_______是还原产物,被还原的HNO3与参加反应的HNO3物质的量之比是___ __。用双线桥标出该反应电子转移的方向和数目。
(2)双线桥标出反应KClO3+ 6HCl=KCl + 3 Cl2↑ + 3H2O电子转移的方向和数目。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: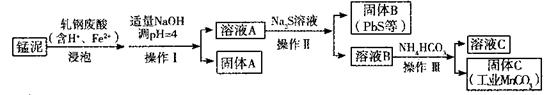
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中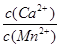 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com