
【题目】关于强弱电解质及非电解质的组合完全正确的是
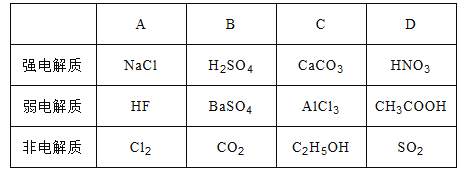
A. A B. B C. C D. D
【答案】D
【解析】A.NaCl溶于水能完全电离,所以NaCl是强电解质;HF在水中只有部分电离,所以属于弱电解质;氯气是单质,不是化合物,所以氯气不是非电解质,故A错误;B.H2SO4溶于水能完全电离,所以H2SO4是强电解质;溶于水的硫酸钡能完全电离,所以硫酸钡是强电解质;CO2自身不能电离出阴阳离子,所以是非电解质,故B错误;C.溶于水的CaCO3能完全电离,所以CaCO3是强电解质;AlCl3在水中完全电离,所以属于强电解质;乙醇的水溶液不导电,所以是非电解质,故C错误;D.HNO3溶于水能完全电离,所以HNO3是强电解质;醋酸在水中只有部分电离,所以属于弱电解质;SO2自身不能电离出阴阳离子,所以是非电解质,故D正确;故选D。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,将少量水加入下列物质中,相关量变化正确的是
A. AgCl悬浊液中 c(Cl-)变小 B. 0.1mol/LCH3COOH溶液中 c(H+)变小
C. 0.1mol/LNa2CO3c(HCO3-)变大 D. 0.1mol/LNH4Cl溶液中 n(OH-)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
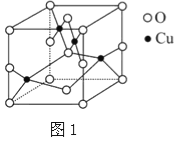
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同, 有关玻璃态水的叙述正确的是( )
A. 水由液态变为玻璃态,体积一定缩小
B. 玻璃态水不可能加工为规则的外形
C. 玻璃态水中水分子间的作用力与冰中不完全相同
D. 玻璃态水是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:图1中a和b分别为常温下盐酸和NaOH溶液互滴的pH变化曲线;图2为常温下CaSO4在水中的沉淀溶解平衡曲线[Ksp(CaSO4)=9×10-6]。下列相关叙述正确的是
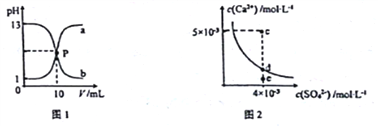
A. 图1中P点溶液:c(Na+)= c(Cl-)>c(H+) = c(OH-)
B. 由图1可知盐酸和NaOH溶液的浓度均为1mol·L-1
C. 图2中c点有沉淀生成,达平衡后溶液中c(SO42-)=3×10-3 mol·L-1
D. 可通过蒸发将图 2中e点的溶液变到d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________
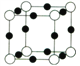
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列叙述正确的是( )
A. pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
B. 在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C. 向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,![]() 将减小
将减小
D. 向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com