
| 选项 | 操作 | 结论 |
| A | 用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 | 该硫酸盐一定含Na+ 一定不含K+ |
| B | 二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 | 酸性条件下NO3-具有强氧化性 |
| C | 在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 | 淀粉没有发生水解 |
| D | 某试样溶液中加入少量稀盐酸,有白色沉淀生成 | 试样中一定含有Ag+ |
| A、A | B、B | C、C | D、D |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
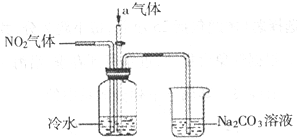
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有SO42- |
| B、一定含有Ag+ |
| C、可能含有SO42-或Ag+ |
| D、一定含有Ag+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(HF) |
| c(H+)?c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液pH减小 |
| C、盐酸中滴加氨水呈中性,溶液中的溶质为氯化铵 |
| D、向沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
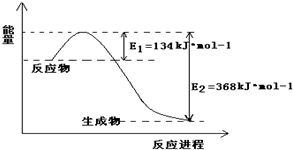 Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式
Ⅰ.(1)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

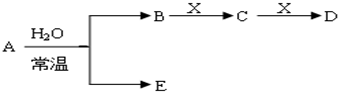
查看答案和解析>>
科目:高中化学 来源: 题型:
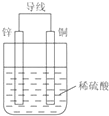 根据铜锌原电池示意图,回答下列问题:
根据铜锌原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42-浓度为3mol/L |
| B、Fe3+的质量为28g |
| C、Fe2(SO4)3浓度为1mol/L |
| D、SO42-为0.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com