
(1)淀粉溶液
(2)碱
(3)溶液由蓝色变为无色,且半分钟内溶液颜色不再变化;0.01
(4)偏大
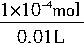 =0.01mol/L。
=0.01mol/L。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:

(1)A、B处应分别加入物质的化学式:A____________,B____________。
(2)现处理这种废水5 L,需加入0.025 mol·L-1亚硫酸钠溶液的体积是多少?
除去Cl2后的废水中H+的物质的量浓度约为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com