
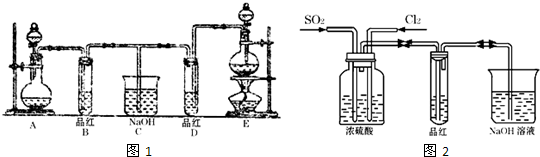
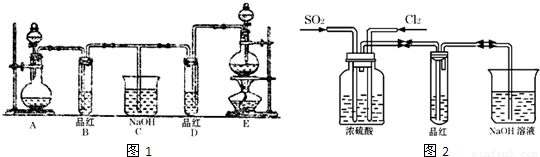
实验室用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:2Cl2+2Ca(OH)2====Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应:6Cl2+6Ca(OH)2![]()
Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如图所示:

(1)a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境,请从这几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
| 优点 | 缺点 | |
| 甲装置 | ||
| 乙装置 | ||
| 丙装置 |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是__________________。
(3)实验室中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________0.15 mol(填“大于”“小于”或“等于”),其原因是(假定各步反应均无反应物损耗,且无副反应发生)________________________。
(1)d ae f ac b ce (2)F、B、E (3)小于 浓盐酸随反应的进行而变为稀盐酸,从而使反应停止
(1)甲有冷凝设备,可以防止合成漂白粉的副反应发生。乙有尾气吸收装置,可以防止环境污染。丙有分液漏斗,可使浓盐酸逐滴滴下,有利于反应速率的?控制。
(2)取甲、乙、丙三装置的优点:丙的气体发生装置、甲的制取漂白粉装置、乙的尾气吸收装置,可组成一套理想的实验装置。
(3)由题意得下列关系式:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
8HCl—Ca(ClO)2
若HCl全部参加了上述反应,则
n〔Ca(ClO)2〕=1/8n(HCl)=12 mol·L-1×0.100 L×1/8=0.15 mol。
事实上,稀盐酸与MnO2不发生氧化还原反应,故n〔Ca(ClO)2〕<0.15 mol。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
查看答案和解析>>
科目:高中化学 来源:2012年人教版高中化学选修1 4.3垃圾资源化练习卷(解析版) 题型:填空题
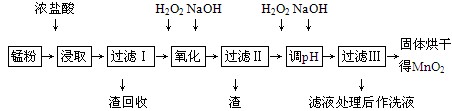
回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、乙炔和黑炭等),由锰粉制取MnO2的步骤如下图所示。
生成氢氧化物沉淀的pH
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
根据上图所示步骤并参考表格数据,回答下列问题。
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为___________________________________________
(2)锰粉经浓盐酸浸取,过滤Ⅰ除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是____________________________________________________________。
(3)过滤Ⅰ所得滤液经氧化后,需加入NaOH溶液调节pH约为5.1,其目的是___________________________________________________________。
(4)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离子方程式为_____________________________________________。
(5)实验室进行过滤操作时,需要用到的玻璃仪器有________________________
查看答案和解析>>
科目:高中化学 来源:2011年山东省济宁一中高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com