
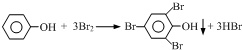
分析 (1)测定废水中苯酚的含量需要通过测定溴的消耗,而剩余的溴单质用HI滴定,生成的碘单质再用0.01mol/L Na2S2O3标准溶液滴定,判断滴定终点的指示剂是淀粉,淀粉遇碘变蓝色,当溶液蓝色消失时即达到滴定终点,所以步骤4中应滴加2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
(2)根据消耗的 Na2S2O3标准溶液的体积计算剩余溴的物质的量,利用2Na2S2O3~I2~Br2,可知剩余溴的物质的量是(0.0085L×0.01mol/L)×$\frac{1}{2}$=4.25×10-5mol,则25mL废水中苯酚的物质的量是[(0.005L×0.01mol/L-4.25×10-5mol)]×$\frac{1}{3}$=2.5×10-6mol,所有苯酚的质量是2.5×10-6mol×94g/mol=2.35×10-4g=0.235mg,该废水中苯酚的含量为$\frac{0.235mg}{0.025L}$=9.4mg/L;
(3)为了防止溴水挥发,影响测定结果,步骤2要塞紧瓶塞;
(4)若步骤3持续时间较长,则空气中的氧气也会氧化碘离子为碘单质,则消耗Na2S2O3标准溶液的体积大于15mL,剩余溴的物质的量偏大,与苯酚反应的溴的物质的量偏小,则苯酚的含量偏低;若滴定至终点时滴定管尖嘴处出现气泡,而滴定前无气泡,则测定的Na2S2O3的体积偏小,剩余溴的物质的量偏小,与苯酚反应的溴的物质的量偏大.
解答 解:(1)步骤4,硫代硫酸钠溶液滴定碘单质,需要加入淀粉溶液做指示剂,滴入2~3滴淀粉溶液,再用0.01mol/L Na2S2O3标准溶液滴定至终点;
故答案为:滴入2~3滴淀粉溶液;
(2)和碘化钾反应的溴单质物质的量:
Br2~I2~2Na2S2O3
1 2
n 0.01mol/L×0.0085L
n=0.0000425mol
n总(Br2)=0.005L×0.01mol/L=0.00005mol,
故与苯酚反应的溴单质为0.00005mol-0.0000425mol=0.0000075mol
则苯酚物质的量=$\frac{1}{3}$×0.0000075mol=0.0000025mol
该废水中苯酚的含量为$\frac{0.0000025mol×94g/mol}{0.025L}$=0.0094g/L=9.4mg/L,
故答案为:9.4;
(3)为了防止溴水挥发,影响测定结果,步骤2要塞紧瓶塞,
故答案为:防止溴水挥发,影响测定结果;
(4)若步骤3持续时间较长,则空气中的氧气也会氧化碘离子为碘单质,则消耗Na2S2O3标准溶液的体积大于15mL,剩余溴的物质的量偏大,与苯酚反应的溴的物质的量偏小,则苯酚的含量偏低;若滴定至终点时滴定管尖嘴处出现气泡,而滴定前无气泡,则测定的Na2S2O3的体积偏小,剩余溴的物质的量偏小,与苯酚反应的溴的物质的量偏大,会使测得的废水中苯酚的含量偏高,
故答案为:偏低;偏高.
点评 本题考查化学工艺流程制备方案、物质含量测定,属于拼合型题目,设计对工艺流程的理解、除杂、氧化还原反应滴定应用等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
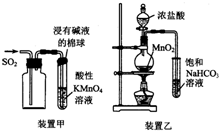
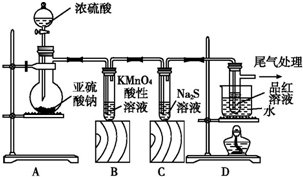
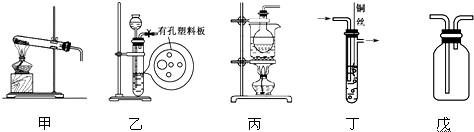
| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液 | |
| D. | 用NaOH溶液除去苯中混有的少量苯酚,反应后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
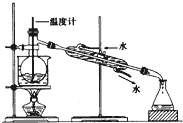
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
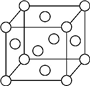 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硅酸钠与盐酸反应制备硅胶:SiO32-+2H+═H2SiO3(胶体) | |
| B. | FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量NaHSO4 溶液与Ba(OH)2 溶液反应:H++OH-+SO42-+Ba2+═H2O+BaSO4↓ | |
| D. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com