
分析 根据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量
(1)根据化学计量数之比等于物质的量之比计算x的值;
(2)由转化率=$\frac{物质的转化量}{物质的起始量}×100%$计算;
(3)根据化学平衡常数K为生成物浓度幂之积与反应物浓度幂之积之比计算.
解答 解:据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量.
平衡时,c的物质的量为2L×0.5mol/L=1mol,
2A (g)+B (g)?x C(g),
开始(mol):3 2 0
变化(mol):1 2-1.5=0.5 1
平衡(mol):2 1.5 1
(1)化学计量数之比等于物质的量之比,所以1:x=1mol:1mol,解得x=2,
故答案为:2;
(2)A的转化率=$\frac{1}{3}×100%$=33.3%;
故答案为:33.3%;
(3)t℃时该反应的平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)•c(B)}$=$\frac{(1mol÷2L)^{2}}{(2mol÷2L)^{2}(1.5÷2L)}$=$\frac{1}{3}$.
故答案为:$\frac{1}{3}$.
点评 本题考查化学平衡计算,难度不大,比较基础,侧重对基础知识的巩固,注意对速率公式的理解与灵活运用以及基础知识掌握与三段式解题法运用.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
① Na2O2和H2O ② Al和NaOH溶液 ③ MnO2和浓盐酸共热 ④ 铜片和浓硫酸共热
A.只有①② B.只有①③ C.只有②③ D.只有③④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
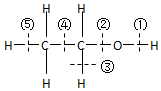
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸能产生无色气体,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com