若NA代表阿伏加德罗常数的值,以下说法正确的是( )
A.9g重水含有的电子数为5NA
B.1molMgCl2中含有的离子数为NA
C.7.1g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1molC10H22分子中共价键总数为31 NA
【答案】
分析:A.重水中的氢,1个重氢原子含1个质子,1个中子,1个重水分子含有10个电子;
B.1molMgCl
2中含有1molMg
2+,含有2molCl
-;
C.氯气与氢氧化钠发生歧化反应,氯从0价的单质氯变成-1价的NaCl中的氯,氯从0价的单质氯变成+1价的NaClO中的氯;
D.C
10H
22分子为烷烃中的癸烷,只存在碳碳单键和碳氢单键.
解答:解:A.重水是摩尔质量为20g/mol,9g重水的物质的量为:9g÷20g/mol=0.45mol,1个重水分子含有10个电子,所以只有4.5mol电子,即4.5N
A,故A错误;
B.MgCl
2的电子式为[
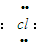
]
-Mg
2+[
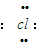
]
-,从电子式可看出1molMgCl
2中含有的离子数为3N
A,故B错误;
C.氯气与氢氧化钠反应:Cl
2+2NaOH=NaCl+NaClO+H
2O,1mol氯气完全反应,氯从0价的单质氯变成+1价的NaClO中的氯,失去1mol电子,氯从0价的单质氯变成-1价的NaCl中的氯,得到1mol电子,7.1gCl
2为0.1mol,转移0.1N
A电子,故C错误;
D.1molC
10H
22分子中,有9mol碳碳单键,有22mol碳氢单键,所以共31mol共价键,1molC
10H
22分子中,共有31N
A个共价键,故D正确;
故选D.
点评:熟悉重水、烷烃、氯化镁的结构,理解氯气与碱反应的原理以及得失电子的关系,是正确解答本题的关键.

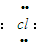 ]-Mg2+[
]-Mg2+[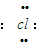 ]-,从电子式可看出1molMgCl2中含有的离子数为3NA,故B错误;
]-,从电子式可看出1molMgCl2中含有的离子数为3NA,故B错误;
