
已知反应X(g)+Y(g)⇌R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内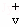 (X)=0.005mol/(L•s).下列说法正确的是( )
(X)=0.005mol/(L•s).下列说法正确的是( )
温度/℃ 700 800 830 1000 1200
平衡常数 1.7 1.1 1.0 0.6 0.4
A. 4 s时容器内c(Y)=0.76 mol/L
B. 830℃达平衡时,X的转化率为80%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应R(g)+Q(g)⇌X(g)+Y(g)的平衡常数K=0.4
考点: 化学平衡的计算.
分析: A.反应初始4s内X的平均反应速率v(X)=0.005mol/(L•s),v(Y)=v(X)=0.005mol/(L•s),Y的起始浓度﹣△c(Y)=4s时c(Y);
B.设平衡时X的浓度变化量为x,利用三段式表示平衡时各组分的平衡浓度,代入平衡常数列方程计算x的值,再根据转化率定义计算;
C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动;
D.该反应X(g)+Y(g)⇌R(g)+Q(g)与R(g)+Q(g)⇌X(g)+Y(g)相反,则平衡常数互为倒数.
解答: 解:A.反应初始4s内X的平均反应速率v(X)=0.005mol/(L•s),速率之比等于化学计量数之比,所以v(Y)=v(X)=0.005mol/(L•s),则4s内△c(Y)=0.005mol•L﹣1•s﹣1×4s=0.02mol/L,Y的起始浓度为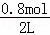 =0.4mol/L,故4s时c(Y)=0.4mol/L﹣0.02mol/L=0.38mol/L,故A错误;
=0.4mol/L,故4s时c(Y)=0.4mol/L﹣0.02mol/L=0.38mol/L,故A错误;
B.设平衡时A的浓度变化量为x,则:
X(g)+Y(g)⇌R(g)+Q(g)
开始(mol/L):0.1 0.4 0 0
变化(mol/L):x x x x
平衡(mol/L):0.1﹣x 0.4﹣x x x
故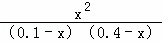 =1,解得x=0.08
=1,解得x=0.08
所以平衡时X的转化率为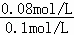 ×100%=80%,故B正确;
×100%=80%,故B正确;
C.由表格可知,温度升高,化学平衡常数减小,平衡逆向移动,不是正向移动,故C错误;
D.1200℃时反应X(g)+Y(g)⇌R(g)+Q(g)的平衡常数值为0.4,所以1200℃时反应R(g)+Q(g)⇌X(g)+Y(g)的平衡常数的值为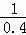 =2.5,故D错误.
=2.5,故D错误.
故选B.
点评: 本题考查化学反应速率、化学平衡常数的计算与运用等,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,注意温度不变时,平衡常数不变,化学方程式相反时,平衡常数互为倒数,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在CuO和Fe粉混合物中,加入一定量稀硫酸微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化.根据上述现象,确定下面结论正确的是( )
|
| A. | 不溶物一定是Cu |
|
| B. | 不溶物一定含铜,但不一定含铁 |
|
| C. | 不溶物一定是Fe |
|
| D. | 溶液中一定含有Fe2+,但不一定含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A. K+、NH4+、OH﹣、SO42﹣ B. H+、Fe2+、SO42﹣、ClO﹣
C. Na+、Ca2+、Cl﹣、CO32﹣ D. K+、Ca2+、Cl﹣、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
)某班学生分成甲,乙两小组分别探究硫,氮及其化合物的性质:
(一)甲组同学用图1装置来探究浓硫酸与木炭粉加热反应并验证反应所产生的各种产物.
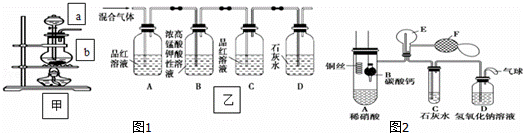
(1)装置甲中盛放浓硫酸的仪器a名称是 ,装置甲中仪器b中发生反应的化学方程式为
(2)实验中可观察到装置乙中,A瓶的溶液褪色,C瓶的溶液不褪色.
A瓶溶液的作用是 ,
D瓶溶液的现象是 .
(二)乙组同学用图2装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离.该组学生设计此步操作的目的是 .
(2)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 .
(3)一段时间后,C中白色沉淀溶解,其原因是
(4)装置D的作用是
查看答案和解析>>
科目:高中化学 来源: 题型:
黑火药爆炸时可发生如下反应:5S+16KNO3+16C=3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
A. S既作氧化剂又作还原剂
B. 消耗12gC时,反应转移5mol电子
C. 还原产物只有K2S
D. KNO3只发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物.
(1)常温下用1mol•L﹣1200mLNaOH溶液恰好完全吸收0.1molSO2气体,此反应的离子方程式为 ,请用离子方程式表示该溶液PH>7的原因 H ,该溶液放置于空气中一段时间后,溶液的PH (填“增大”“减小”或“不变”)
(2)SO2能使酸性高锰酸钾溶液褪色,该反应的离子方程式为 ,实验室通常选择 (选填“稀盐酸”、“稀硫酸”)对高锰酸钾溶液进行酸化.
(3)课本中选用Na2S2O3与稀硫酸的反应来研究物质的温度对化学反应速率的影响.选用Na2S2O3来比较化学反应速率快慢的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液、胶体和浊液这三种分散系的根本区别是( )
A.是否是大量分子或离子的集合体
B.分散质粒子的大小
C.是否能通过滤纸
D.是否均一、透明、稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
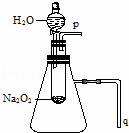
实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, .Na2O2跟水反应的化学方程式是 .
(2)某研究性学习小组拟用A图所示装置(气密性良好)进行实验,以证明上述结论.用以验证第一条结论的实验方法是: ;用以验证第二条结论的实验方法是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应NaClO+2HCl=NaCl+H2O+Cl2↑,被氧化的氯原子与被还原的氯原子之比是( )
|
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com