
C和Si元素在化学中占有极其重要的地位。
(1)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为________,微粒间存在的作用力是________。
(2)氧化物MO的电子总数与SiC的相等,则M为________(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是_____________。
(3)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键_________
________________________________________________________________________
________________________________________________________________________。
科目:高中化学 来源: 题型:
有关等离子体的叙述,不正确的是( )
A.等离子体是物质的另一种聚集状态
B.等离子体是很好的导体
C.水不可能形成等离子体状态
D.等离子体的用途十分广泛
查看答案和解析>>
科目:高中化学 来源: 题型:
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
( )
①加盐酸溶解;②加烧碱溶液溶解;③过滤;④通入过量CO2生成Al(OH)3沉淀;⑤加入盐酸生成Al(OH)3沉淀;⑥加入过量烧碱溶液。
A.①⑥⑤③ B.②③⑤③
C.②③④③ D.①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学利用如图装置实现铜与浓硝酸、稀硝酸反应,过程如下:
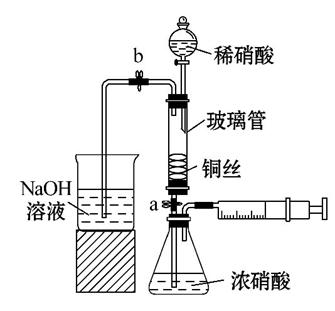
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)过程Ⅰ发生反应的离子方程式是____________________________。
(2)写出过程Ⅲ中检查气密性的方法____________________________。
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是____________,一段时间后使反应停止的操作是__________,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目的是______________,该反应的离子方程式是__________________。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升的高度 |
| 1 | 25 | 超过试管的2/3 |
| 2 | 50 | 不足试管的2/3 |
| 3 | 0 | 液面上升超过实验1 |
①根据上表得出的结论是温度越______(填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为2NO2+H2O====HNO3+HNO2,3HNO2====HNO3+2NO↑+H2O;
b.HNO2不稳定。
则产生上述现象的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质适合于分子晶体的是( )
A.熔点1 070°C,易溶于水,水溶液能导电
B.熔点10.31°C,液态不导电,水溶液导电
C.难溶于CS2,熔点1 128°C,沸点4 446°C
D.熔点97.81°C,质软导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.稀有气体形成的晶体属于分子晶体
C.干冰升华时,分子内共价键会发生断裂
D.金属元素和非金属元素形成的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,科学家成功制得了CO2的原子晶体(以下用M表示)。下列关于M的推断正确的是( )
A.M具有很高的熔、沸点
B.M容易气化,可用作致冷材料
C.M和干冰互为同素异形体
D.M是由C原子和O原子按1∶2的比例所组成的平面网状的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属卤化物是典型的离子晶体,它们的晶格能与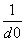 成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
| 晶格能/kJ·mol-1 | 离子半径/pm | |
| ① | LiF LiCl LiBr LiI 1 031 845 807 752 | Li+ Na+ K+ 60 95 133 |
| ② | NaF NaCl NaBr NaI 915777 740 693 | F- Cl- Br- I- 136 181 195 216 |
| ③ | KF KCl KBr KI 812 708 676 641 |
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,还原性越强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com