
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是
A. 12 g金刚石中含有化学键的数目为4NA
B. 18 g的D2O中含有的质子数为10
C. 28 g的乙烯和环已烷混合气体中所含原子总数为6NA
D. 1 L 1mol·L1的NH4Cl溶液中NH4+和Cl―的数目均为1NA
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
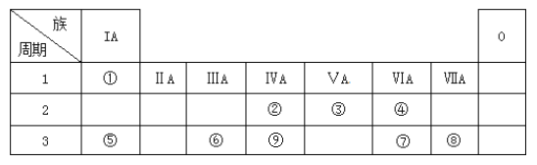
(1)第三周期中元素非金属性最强的元素的原子结构示意图为__________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)_____________。
(3)用电子式表示④的氢化物的形成过程_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是__________。
a. ⑤单质的熔点比⑥单质低
b. ⑤的化合价比⑥低
c. ⑤单质与水反应比单质⑥剧烈
d. ⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
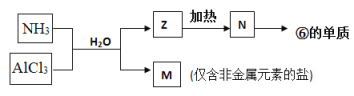
a. M中所含的化学键种类为(若含共价键,请标明极性或非极性)_________。
b. N→⑥的单质的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
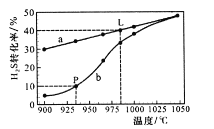
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe 四种金属元素组成,回答下列问题:
(1)基态Fe原子有_______个未成对电子,Fe3+的价电子排布式为__________。
(2)新制的Cu(OH)2可将乙醛氧化成乙酸,而自身还原成Cu2O。乙醛分子中含有的σ键与π键的比例为___。乙醛中碳原子的杂化轨道类型为_____,配合物[Cu(NH3)4](OH)2中含有的化学键类型有_________,1 mol该物质中有______个σ键。
(3)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有______个铜原子。
(4)CaCl2熔点高于AlCl3的原因__________________________________。
(5)CaF2晶胞如图所示,已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3·5H2O),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:
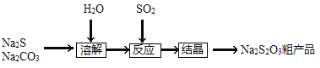
某化学兴趣小组同学模拟该流程设计了如下实验装置:
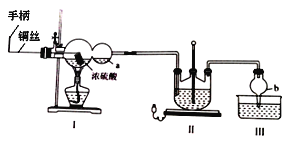
回答下列问题:
(1)双球管a处的液体可用来检验I中的反应是否发生,选用的试剂是______(填字母)
a、品红溶液 b、NaOH溶液 c、稀硫酸
若要停止I中的化学反应,除停止加热外,还要采取的操作是___________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O;②可能是CuO;③可能是CuS;④CuS和CuO的混合物。乙同学提出假设①一定不成立,该同学的依据是____________________________________;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,原黑色物质的组成为____________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________________________________________。
(4)丁同学提出上述实验装置的设计存在不足,建议在I上_____________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图所示。活化氧可以快速氧化SO2。下列说法正确的是

A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为__________________。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式____________。配制的FeCl3溶液应保持_______(填“酸性”“碱性”或“中性”),原因是_____________。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I―=2CuI↓+I3- ②I3- +2S2O32-=3I―+2S2O62-
反应①中的氧化剂为_____________。现取20.00 mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000 mol·L1 Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00 mL,此溶液中Cu2+的浓度为_______mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空格。
(1)已知拆开1molH-H键、1molCl-Cl键、1molH-Cl键分别需要吸收的能量为436.4kJ、242.7kJ、431.8kJ。则由H2和Cl2反应生成1molHCl需要_____(填“放出”或“吸收”)____kJ的热量。
(2)H2可以在Cl2中安静地燃烧。甲、乙两图中,能表示该反应能量变化的是图_____(填“甲”或“乙”)。

(3)已知:H2与Cl2在光照条件下会发生爆炸。同温同压下,反应H2(g)+Cl2(g)=2HCl(g)。在光照和点燃条件下的H_____(填“相等”或“不相等”)。
(4)硅、磷、硫、氯元素的气态氢化物的形成条件和热稳定性如下表所示:
元素符号 | Si | P | S | Cl |
单质与氢气的反应 | 高温下反应 | 磷蒸气与氢气能反应 | 加热时反应 | 光照或点燃时发生爆炸而化合 |
气态氢化物的热稳定性 | 不稳定 | 不稳定 | 受热分解 | 稳定 |
结合元素原子结构等知识,分析以上信息可得出的结论是:同周期非金属元素,随着元素核电荷数的递增,____________________________________,因此,Si、P、S、Cl非金属性依次增强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com