
| A. | H2O | B. | SO32- | C. | NH3 | D. | CCl4 |
分析 价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型.
价层电子对个数为4,不含孤电子对,为正四面体结构;含有一个孤电子对,空间构型为三角锥形,含有两个孤电子对,空间构型是V型;
价层电子对个数为3,不含孤电子对,平面三角形结构;含有一个孤电子对,空间构型为为V形结构;
价层电子对个数是2且不含孤电子对,为直线形结构,据此判断.
解答 解:A.水分子中氧原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,VSEPR模型为正四面体结构,含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,故A错误;
B.SO32-中孤对电子为$\frac{6+2-3×2}{2}$=1,σ 键电子对均为3,价层电子对个数=1+3=4,S原子采取sp3杂化,VSEPR模型为正四面体结构,含有一个孤电子对,空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,故B错误;
C.氨气分子中氮价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(5-3×1)=4,VSEPR模型为正四面体结构,含有一个孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,故C错误;
D.CCl4中碳原子价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化,VSEPR模型为正四面体结构,不含有孤电子对,所以其空间构型为正四面体结构,VSEPR模型与分子立体结构模型一致,故D正确;
故选D.
点评 本题考查了价层电子对互斥模型和微粒的空间构型的关系,根据价层电子对互斥理论来分析解答,注意孤电子对个数的计算方法,为易错点,注意实际空间构型要去掉孤电子对为解答关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 酒精(水) | 生石灰 | 蒸馏 |
| C | 苯(甲苯) | 酸性KMnO4溶液 | 分液 |
| D | 乙烷(乙烯) | Br2的CCl4溶液 | 洗气 |
| A. | A | B. | B | C. | C D.D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
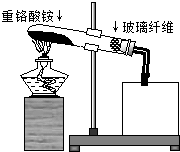 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
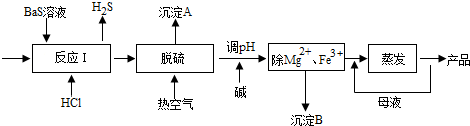
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
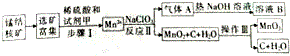
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
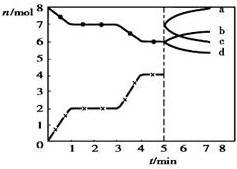
| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com