
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
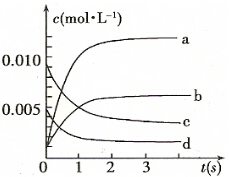
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 50% | D. | 9 5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.
可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
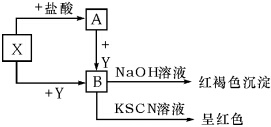 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
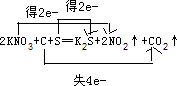 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com