
【题目】下表中金属难与表中其他金属形成二元合金的是( )
Fe | Cu | Zn | Ag | Au | W | |
熔点 | 1535 | 1083 | 419.5 | 962 | 1064 | 3410 |
沸点 | 3000 | 2595 | 907 | 2212 | 2707 | 5627 |
A.Cu、FeB.Fe、AuC.Zn、WD.Cu、Ag
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在0.1mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示该反应的化学反应速率为0.2 mol·L-1·min-1,则以物质B表示此反应的化学反应速率为________mol·L-1·min-1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2的物质的量为1.9 mol,则以H2的浓度变化表示的反应速率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波,主要用于照相业作定影剂、作鞣革时重铬酸盐的还原剂,易溶于水,遇酸易分解。其工艺制备流程如下:

某化学兴趣小组同学模拟该流程设计了如下实验装置:

回答下列问题:
(1)a处可用来检验I中的反应是否发生,选用的试剂是______________,若要停止I中的化学反应,除停止加热外,还要采取的操作是________________________。
(2)加热I,使反应完全,发现浸入液面下的铜丝变黑,甲同学对黑色生成物提出如下假设:①可能是Cu2O ②可能是CuO;③可能是CuS;④_______。乙同学提出假设①一定不成立,该同学的依据是______;丙同学做了如下实验来验证黑色物质的组成:

基于上述假设分析,黑色物质的组成为__________________________(填化学式)。
(3)II中发生反应的化学方程式为_____________________,实验中通入的SO2不能过量,可能的原因是______________________。
(4)为检验制得的硫代硫酸钠产品的纯度,该小组称取5.0g产品配成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:向锥形瓶中加入25.00mL 0.01mol·L-1的KIO3溶液,再加入过量的KI溶液并酸化,发生反应的离子方程式为___________,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应I2 + 2S2O32- == 2I- + S4O62-,当达到滴定终点时,消耗Na2S2O3溶液20.00mL,则该产品的纯度是____________(保留3个有效数字)。
(5)丁同学提出上述实验装置的设计存在不足,建议在I上__________;在I、II之间增加_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列方案对A盐的水解液进行鉴定:
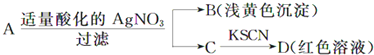
由此得出的结论中,不正确的是( )
A.D溶液中存在Fe(SCN)3 B.滤液中有Fe3+
C.B为AgBr D.A一定为无氧酸盐FeBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,实验测得加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如下图所示。下列叙述正确的是

A. HA溶液的物质的量浓度为0.01 mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离常数K约为1.25×10-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com