
 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.分析 (1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$=8:11;
(3)根据催化剂的特点可知另一个反应一定实现Fe3+→Fe2+,据此写出另一个反应的离子方程式;
(4)依据氧化还原反应的电子守恒计算ZnFe2Oy中Fe元素化合价,再根据化合物中的元素化合价代数为0计算y的值;
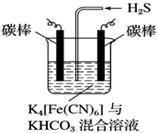
(5)电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,据此判断.
解答 解:(1)酸性溶液中发生氧化还原反应,Mn元素的化合价降低,则Fe元素的化合价升高,发生的离子反应为2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O,
故答案为:2Fe2++MnO2+4H+═Mn2++2Fe3++2H2O;
(2)生成的氧化物中Fe、O两种元素的质量比为28:11,则原子个数比为$\frac{28}{56}$:$\frac{11}{16}$═8:11,则化学式为Fe8O11,故答案为:Fe8O11;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2═2Fe2++SO42-+4H+,通过该反应,吸收了大气污染物SO2,同时制得了硫酸,
故答案为:2Fe3++SO2+2H2═2Fe2++SO42-+4H+;
(4)2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则ZnFe2Oy被还原为ZnFe2O4,令ZnFe2Oy中铁元素的化合价为a,根据电子转移守恒,可知2mol×2×(3-a)=0.5mol×2×4,解得a=2,化合价代数和为0,则2+2×2=2y,解得y=3,
故答案为:3;
(5)电解时,阳极的电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-.
点评 本题考查氧化还原反应计算及电解等,综合性较强,注重氧化还原反应应用能力的考查,把握习题中的信息及迁移应用为解答的关键,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
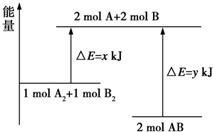
| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
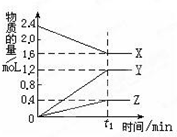 某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.
某温度下,在2L密闭容器中,3种气态物质X、Y、Z的物质的量随时间 变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | “臭氧空洞”“温室效应”“光化学烟雾”“硝酸型酸雨”的形成过程都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、石油中提取石蜡等过程中都包含化学变化 | |
| C. | 低碳经济就是以低耗能、低污染、低排放为基础的经济发展模式 | |
| D. | 可利用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com