
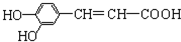 下列有关咖啡酸的说法中,不正确的是( )
下列有关咖啡酸的说法中,不正确的是( )| A. | 1 mol咖啡酸可与3 mol NaOH发生反应 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1 mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1 mol咖啡酸最多可与5 mol H2发生加成反应 |
分析 由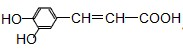 结构简式可知,分子中含酚-OH、-COOH、碳碳双键,结合酚、羧酸、烯烃的性质来解答.
结构简式可知,分子中含酚-OH、-COOH、碳碳双键,结合酚、羧酸、烯烃的性质来解答.
解答 解:A.1mol咖啡酸含有2mol酚羟基和1mol羧基,所以1 mol咖啡酸能消耗3mol的NaOH,故A正确;
B.含碳碳双键,可发生还原、加聚反应,含-OH、-COOH可发生酯化反应,含酚-OH,则与FeCl3溶液可以发生显色反应,故B正确;
C.苯环上羟基的临对位上能够与溴发生取代反应,碳碳双键能够与溴发生加成反应,所以1mol咖啡酸可与4mol Br2发生反应,故C正确;
D.苯环与碳碳双键与氢气发生加成反应,则1 mol咖啡酸可与4 mol H2发生加成反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重羧酸、酚、烯烃性质的考查,选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题

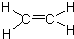 ,C的名称为乙醛
,C的名称为乙醛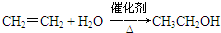 ;反应类型是加成反应;
;反应类型是加成反应;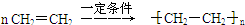 ;反应类型是加聚反应.
;反应类型是加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
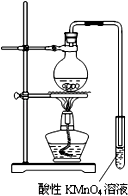 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中加足量Ba(OH)2 溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 酸性溶液中KIO3与 KI反应生成 I2:IO3-+I-+6H+=I2+3H2O | |
| C. | NaHCO3 溶液与稀硫酸反应:CO32-+2H+=H2O+CO2↑ | |
| D. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: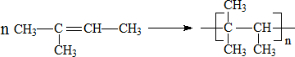 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
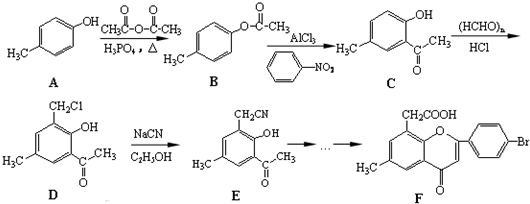
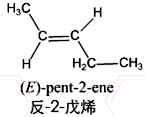
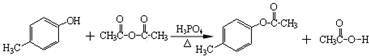 .
.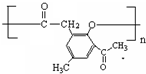 .
.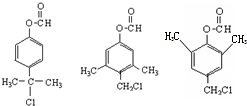 .
.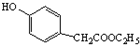 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下: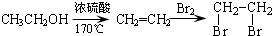
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
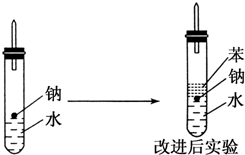 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸 ②Na+水 ③Al+NaOH溶液.为分析上述三个反应生成的H2,他们设计了如下装置图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
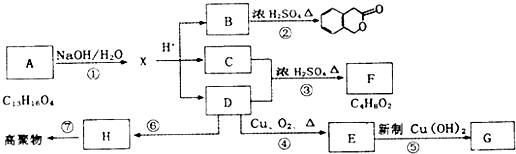
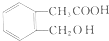
 ④
④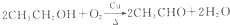 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢能源的优点是来源广泛、无污染、便于运输与贮存 | |
| B. | 自然界中利用太阳能最成功的是植物的光合作用 | |
| C. | 植物秸秆、动物粪便、枯枝败叶中蕴藏着丰富的生物质能 | |
| D. | 利用太阳能、风能和氢能替代化石能源能改善空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com