
【题目】将一定质量Mg、Zn、Al的混合物与足量稀H2SO4反应,生成H2 2.8L(标准状况),则原混合物的质量不可能是( )
A.2g B.4g C.6g D.8g
科目:高中化学 来源: 题型:
【题目】由CO和CO2组成的混合气体,密度是相同条件下氢气密度的18倍,则该混合气体中CO和CO2的体积比为 ( )
A.1:1 B.1:2 C.2:1 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.为了除去粗盐中Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。其中正确的操作顺序是 。
A①④②⑤③ B④①②⑤③ C②⑤④①③ D⑤②④①③ E①②⑤④③
II.实验室里需要纯净的氯化钠溶液,现只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如下方案:
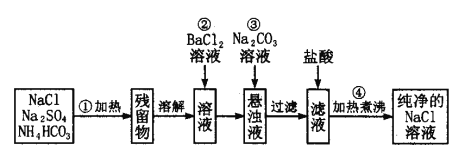
(1)操作①中发生的化学反应方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O↑
NH3↑+CO2↑+H2O↑
则可选择________容器进行加热(选填:试管、量筒、容量瓶、分液漏斗)
(2)操作②反应的化学反应方程式为: ,能否用硝酸钡溶液代替氯化钡 (填“能”或“不能”)原因是: ;
(3)为了达到实验目的,进行操作②后,如何判断溶液中SO42-已除尽,其方法有_________。
A.静置,向上层清液中滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
B.静置,取上层清液于试管中,滴加硫酸钠,若有沉淀生成,则说明原溶液中的SO42-已除尽
C.静置,向上层清液中滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
D.静置,取上层清液于试管中,滴加氯化钡溶液,若无沉淀生成,则说明原溶液中的SO42-已除尽
E.静置,取上层清液于试管中,滴加硝酸银溶液,若有沉淀生成,则说明原溶液中的SO42-已除尽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2+Cl2![]() 2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
2HCl,一定条件下,某H2和Cl2的混合气体7.5 g 含有3.612×1023个原子,充分反应后,下列说法正确的是( )
A.反应后所得气体比相同状况下空气的密度大
B.反应后所得气体在标准状况下的体积为6.72L
C.反应后所得气体中H原子和Cl原子的物质的量之比为1:2
D.反应后所得气体可被100mL 1mol/L NaOH溶液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氢气的燃烧热是285.8KJ/mol,则表示氢气燃烧热的热化学方程式为 ;
(2)1.6g液态化合物N2H4与液态H2O2恰好完全反应生成两种对环境友好的气体,此时放出75KJ的热量,请写出该反应的热化学方程式 ;
(3)已知Ba2++SO42-=BaSO4(s)△H=-aKJ/mol(视a为已知数),请写出稀硫酸与稀Ba(OH)2溶液反应的热化学方程式 ;
(4)已知2NH3(g)![]() N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
N2(g)+3H2(g)△H=+92.4KJ/mol,把1molN2(g)和3molH2充入密闭容器中充分反应,测得放出的热量始终小于92.4KJ。请简述其原因 ;
(5)请仔细看图,
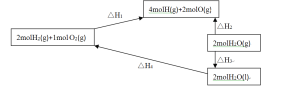
根据盖斯定律,△H4=(用△H1、△H2、△H3表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中,反应aA(g)![]() bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
bB(g)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,A物质的量浓度变为原来的60%,则ab(填“>、=、<”),简述其理由。
(2)在恒温时,在固定容器中充入N2O4,发生反应N2O4(g)![]() 2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
2NO2(g),在达到平衡后,若又向容器中充入一定量的N2O4,当达到新平衡时,反应体系中NO2(g)的体积分数将(增大、减小、不变)。
(3)在一定体积的密闭容器中,进行反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
CO(g)+H2O(g),其反应化学平衡常数和T的关系如下表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200[来 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
A.对于CO(g)+H2O(g)![]() CO2(g)+H2(g)此平衡体系,升温平衡向移动。
CO2(g)+H2(g)此平衡体系,升温平衡向移动。
B.达到平衡后,若压缩容器的体积,正逆反应速率的变化是。
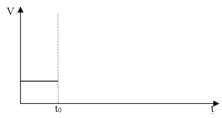
C.对原平衡,在t0时升高温度对化学反应速率产生影响,请在下图中绘出速率变化图:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯氧化铁是现代电子工业的重要材料。以下是用硫酸厂产生的烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁a-Fe2O3)的生产流程示意图:
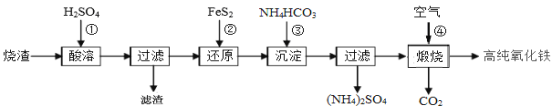
(1)酸浸时,常需将烧渣粉碎、并加入过量H2SO4,其目的是 ;
滤渣的主要成分为 (填化学式)。
(2)加入FeS2时,发生反应②的离子方程式为 。
(3)加入NH4HCO3目的是 。“沉淀”时,pH不宜过高,否则制备的FeCO3中可能混有的杂质是 。检验FeCO3是否洗涤干净的方法是 。
(4)煅烧时,发生反应④的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2溶于水,Cl2和水反应时转移电子数为NA
B.标准状况下,40gSO3中含有分子的数目为0.5NA
C.标准状况下,2.24L由乙烯和聚乙烯组成的混合物中含有原子的数目为0.6NA
D.常温常压下,10g46%酒精水溶液中含氧原子总数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com