

| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g)=2H2O(l)ΔH= -Q1kJ·mol-1; 2H2(g)+O2(g)=2H2O(g)ΔH=-Q2kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g)ΔH = -Q1 kJ·mol-1; S(s)+O2(g)=SO2(g)ΔH=-Q2kJ·mol-1 |
| C.C(s)+1/2O2(g)=CO(g)ΔH = -Q1 kJ·mol-1; C(s)+O2(g)=CO2(g)ΔH=-Q2kJ·mol-1 |
| D.H2(g)+Cl2(g)=2HCl(g)ΔH = -Q1kJ·mol-1; 1/2H2(g)+1/2Cl2(g)="HCl(g)" ΔH= -Q2kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
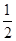 O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,
O2(g)=== ZnO(s),ΔH=" -348.3" kJ·mol-1,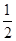 O2(g)=== Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
O2(g)=== Ag2O(s),ΔH=" -31.0" kJ·mol-1,则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )| A.-317.3 kJ·mol-1 | B.-379.3 kJ·mol-1 | C.-332.8 kJ·mol-1 | D.317.3 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI(g) △H=-9.48 kJ·mol-1
2HI(g) △H=-9.48 kJ·mol-1  2HI(g) △H=+26.48 kJ·mol-1
2HI(g) △H=+26.48 kJ·mol-1| A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ |
| B.当反应②吸收52.96kJ热量时转移2mole一 |
| C.反应②的反应物总能量比反应①的反应物总能量低 |
| D.1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.350KJ | B.700KJ | C.200KJ | D.250KJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ;HCl(aq)与NaOH反应的
;HCl(aq)与NaOH反应的 ,则HCN在水溶液中电离的
,则HCN在水溶液中电离的 等于
等于A.  | B.- 43.5 | C.+ 43.5 | D.+ 67.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=CO(g)
O2(g)=CO(g)  H1=-110.5 kJ/mol
H1=-110.5 kJ/mol H2=-483.6 kJ/mol
H2=-483.6 kJ/mol H3。
H3。 H3= kJ/mol
H3= kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com