
 )互为同分异构体,且能发生银镜反应,分子中含有苯环、但不含-CH3的化合物有多种,它们的结构简式是
)互为同分异构体,且能发生银镜反应,分子中含有苯环、但不含-CH3的化合物有多种,它们的结构简式是 、
、 、
、 、
、 ,还有
,还有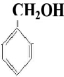 、
、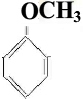 或HO-C6H4-CH3,有2个取代基时,有邻、间、对三不同结构:
或HO-C6H4-CH3,有2个取代基时,有邻、间、对三不同结构: 、
、 、
、 ,
, 、
、
 ;
; ;
; ;
;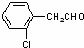 、
、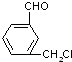 、
、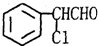 ,
, ;
; ;
;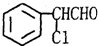 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 |
氧化性:Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 | 有气体生成 | Ksp(BaCO3)<Ksp(BaSO4) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①可用于实验室制取少量NH3或O2 |
| B、可用从a处加水的方法检验装置②的气密性 |
| C、利用装置③实现NaOH溶液滴定盐酸 |
| D、利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢: Mg>Al>Fe | 反应物的性质越活泼, 反应速率越快. |
 (1)该同学的实验目的是
(1)该同学的实验目的是查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验组 | T/℃ | 其实浓度/mol?L-1 | 等质量催化剂的比 表面积/m3?g-1 | |
| CO | H2 | |||
| ① | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| ② | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| ③ | 350 | 124 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、等物质的量的甲基与羟基所含电子数相等 |
| C、淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com