
| A. | C3H7Cl | B. | C3H8 | C. | C3H6 | D. | C |
分析 分子式只能表示一种物质,就是说它不存在同分异构体,同分异构体是分子式相同,但结构不同的化合物,根据是否存在同分异构体判断正误.
解答 解:A、C3H7Cl存在同分异构体:CH3CH2CH2Cl,CH3CHClCH3,所以不能只表示一种物质,故A不符合;
B、C3H8为丙烷,只有一种结构不存在同分异构体,所以能只表示一种物质,故B符合;
C、C3H6存在同分异构体:CH2=CH-CH3,环丙烷,所以不能只表示一种物质,故C不符合;
D、碳元素存在同素异形体,C可以表示金刚石、石墨等,所以不能表示一种物质,故D不符合;
故选:B.
点评 本题考查同分异构体书写,题目难度不大,主要是对基础知识的理解与掌握,熟练掌握基础是解题关键.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
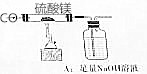 确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:
确定反应的化学方程式和制得的MgO的纯度,称量MgSO410.0g,放置于石英管中,按右图连接装置进行试验.试验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).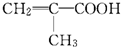 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$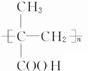 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后得到的上层清液,加入2滴K4[Fe(CN)6](亚铁氰化钾)溶液 | 若产生暗蓝色沉淀,则猜想一不成立. |
| 步骤二:取探究Ⅲ中所得溶液,加入少量乙醚,充分振荡,静置分层 | 若乙醚层呈红色,则猜想二成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可根据硫酸密度的大小判断铅蓄电池是否需要充电 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内原子总数不变 | B. | 容器内压强不变 | ||
| C. | 容器内分子总数不变 | D. | 发生的反应属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;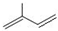 ;
;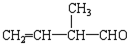 所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键、醛基;该有机物发生加聚反应后,所得产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入NaHCO3溶液产生气体,表示含有-COOH或酚羟基 | |
| B. | 遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质 | |
| C. | 加入新制的Cu(OH)2悬浊液,加热煮沸有红色沉淀生成,或加入银氨溶液加热有银镜生成,表示含有-CHO | |
| D. | 某有机物与醋酸反应,相对分子质量增加42,则含有1个-OH;增加84,则含有2个-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
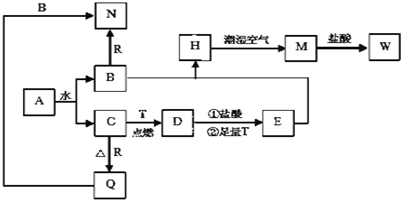
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com