
| A. | 乙烯能使酸性高锰酸钾溶液褪色,发生了加成反应 | |
| B. | 苯可以使溴水褪色,发生了取代反应 | |
| C. | 乙醛在一定条件下与氢气反应生成乙醇,发生了氧化反应 | |
| D. | 苯在一定条件下能与浓硝酸反应得到硝基苯,发生了取代反应 |
分析 A.乙烯被高锰酸钾氧化;
B.苯可以使溴水褪色,发生萃取;
C.乙醛在一定条件下与氢气反应生成乙醇,-CHO转化为-OH;
D.苯在一定条件下能与浓硝酸反应得到硝基苯,苯中H被硝基取代.
解答 解:A.乙烯能使酸性高锰酸钾溶液褪色,发生了氧化反应,故A不选;
B.苯可以使溴水褪色,发生萃取,为物理变化,故B不选;
C.乙醛在一定条件下与氢气反应生成乙醇,-CHO转化为-OH,为加成反应或还原反应,故C不选;
D.苯在一定条件下能与浓硝酸反应得到硝基苯,苯中H被硝基取代,为取代反应,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
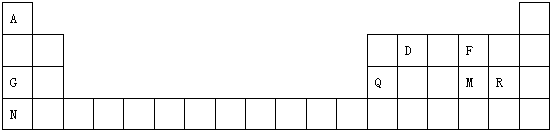
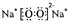 ,该物质含有的化学键的类型是离子键、非极性共价键 .
,该物质含有的化学键的类型是离子键、非极性共价键 .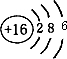 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质中一定存在共价键 | |
| C. | 共价化合物中一定存在共价键 | |
| D. | 离子化合物中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
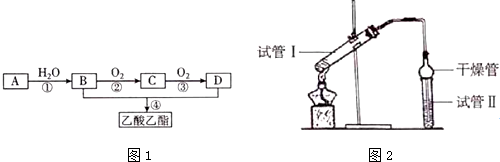
| 实验编号 | 试管I中试剂 | 试管Ⅱ中有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、2mL 18mol•L-1浓硫酸 | 3.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL 乙醇、2mL 乙酸 2mL3mol•L-1H2SO4 | 0.6 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液的pH相同 | |
| B. | NH3•H2O的电离方程式:NH3•H2O=NH4++OH- | |
| C. | 分别与等物质的量浓度、等体积的盐酸混合后,所得溶液都显中性 | |
| D. | 等体积的两溶液与硫酸完全反应,消耗硫酸的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
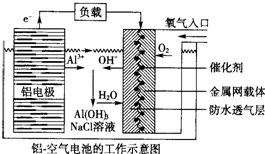
| A. | NaCl的作用是增强溶液的导电性 | |
| B. | 正极的电极反应式为O2+4e-+2H2O=4OH- | |
| C. | 电池工作过程中,电解质溶液的pH不断增大 | |
| D. | 用该电池作电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 每生成0.3molH2,被还原的水分子数目为0.6NA | |
| B. | 当有2.7gAl参加反应时,转移的电子数目为0.3NA | |
| C. | 每生成6.72L的H2,溶液中AlO2-的数目就增加0.2NA | |
| D. | 溶液中每增加0.1mol的AlO2-,Na+的数目就增加0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界里Na元素只以化合态存在 | |
| B. | 钠与水反应放出氧气 | |
| C. | 钠放置在空气中很快被氧化为白色Na2O2 | |
| D. | 钠投入稀CuSO4溶液中,可置换出金属Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com