
【题目】可逆反应A+a B![]() C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是
C+2 D(a为化学计量数),已知B、C、D为气态物质。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是

A.T2>T1,p2>p1
B.该反应为放热反应
C.若a=2,则A为液态或固态物质
D.增加B的物质的量,该反应的![]() H增大
H增大
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: ![]()
![]()
![]() ?
?![]() ?
?![]() ,反应一段时间后达到平衡,测得生成
,反应一段时间后达到平衡,测得生成![]() ,且反应的前后压强之比为
,且反应的前后压强之比为![]() 相同的温度下测量
相同的温度下测量![]() ,则下列说法正确的是
,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=c(C)4c(D)2/c(A)3c(B
B.此时,B的平衡转化率是![]()
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
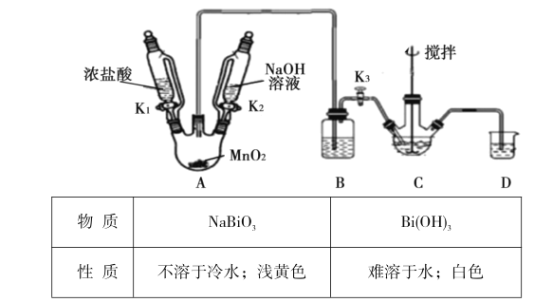
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,将
时,将![]()
![]() 气体充入2L密闭容器中,发生下列反应:
气体充入2L密闭容器中,发生下列反应:![]() ,每隔一段时间对该容器的物质进行测量,得到的数据如表:下列说法中正确的是
,每隔一段时间对该容器的物质进行测量,得到的数据如表:下列说法中正确的是
时间 | 0 | 20 | 40 | 60 | 80 |
|
|
|
|
|
|
|
|
|
|
|
|
A.反应开始20s内![]() 的平均反应速率是
的平均反应速率是![]()
![]()
B.80s时混合气体的颜色与60s时颜色相同,比40s时的颜色深
C.80s时向容器内加![]() molHe,容器体积保持不变,化学反应速率加快
molHe,容器体积保持不变,化学反应速率加快
D.80s时升高温度,则正反应速率加快,逆反应速率也加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图象及其相关说法正确的是( )
图①: 图②:
图②:
图③: 图④ :
图④ :
A.据图①可判断:2O3(g)=3O2(g);△H= - 44.8KJ/mol
B.据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo
C.据图③可判断: 2O2(g)═O3(g)+O(g)△H>0
D.据图④可判断:2NO2(g)+O3(g) ![]() N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol·L-1·S-1
N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol·L-1·S-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等。可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得。工艺流程如下图:
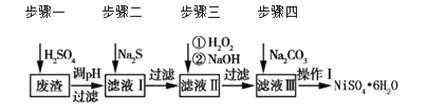
请回答下列问题:
(1)用稀硫酸溶解废渣时,为了提高浸取率可采取的措施有_______(任写一点)。
(2)向滤液中滴入适量的Na2S溶液,目的是除去Cu2+、Zn2+,写出除去Cu2+的离子方程式________。
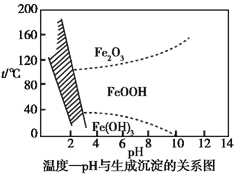
(3)在40 ℃左右,用6%的H2O2氧化Fe2+,再在95 ℃时加入NaOH调节pH,除去铁和铬。此外,还常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠![]() (OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
(OH)12]沉淀除去。如图是温度—pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域[已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39]。下列说法正确的是_______(选填序号)。
a.FeOOH中铁为+2价
b.若在25 ℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+的离子方程式为:6Fe2++Cl![]() +6H+
+6H+![]() 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
d.工业生产中常保持在85~95 ℃生成黄铁矾钠,此时水体的pH为1.2~1.8
(4)上述流程中滤液Ⅲ的主要成分是_______。
(5)确定步骤四中Na2CO3溶液足量,碳酸镍已完全沉淀的简单实验方法是_______。
(6)操作Ⅰ的实验步骤依次为(实验中可选用的试剂:6 mol·L-1的H2SO4溶液、蒸馏水、pH试纸):
①___________;
②___________;
③蒸发浓缩、冷却结晶,过滤得NiSO4·6H2O晶体;
④用少量乙醇洗涤NiSO4·6H2O晶体并晾干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2g铜投入100mL 14mol/L浓HNO3 溶液中,充分反应后无固体剩余,收集到标准状况下气体8.96L。计算:
(1)所得气体的质量_____
(2)向反应后的溶液中加入多少毫升10mol/L NaOH溶液才能使Cu2+完全沉淀?____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿为原料制备氯化铁晶体(FeCl3·6H2O,270.5 g·mol-1)的工艺流程如图所示。

请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为______、__________。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为__________。
(3)过滤操作用到的玻璃仪器有烧杯、________、________。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为______、______。
(5)先向氯化铁溶液中加适量盐酸的目的是_________,再____、______、过滤、洗涤,最终得到氯化铁晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com