
| A、c (Na+)=c (CH3COO-)+c (CH3COOH) |
| B、c (Na+)>c (CH3COO-) |
| C、c (Na+)+c (H+)=c (CH3COO-) |
| D、c (Na+)=c (CH3COO-) |
科目:高中化学 来源: 题型:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能(kJ?mol-1) | 198 | 360 | 498 | X |
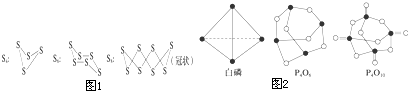
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| B、该电池放电时溶液中Li+的离子移向正极 |
| C、该电池的负极电极反应式为Al-3e-=Al3+ |
| D、充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入铝产生H2的溶液:NO3-、NH4+、Ba2+、Cl-、Na+ |
| B、使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- |
| C、0.1mol/L的FeCl3溶液:Ba2+、NO3-、Na+、Cu2+、I- |
| D、0.1mol/L的NH4Cl溶液:K+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.6L氯气与27g铝充分反应,转移的电子数一定为3NA |
| B、用0.2mol Cl2溶解于10L的水中,可生成0.2NA个HClO |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、0.012kg 13C中,含碳原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
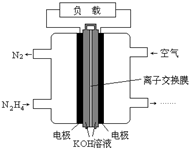 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述不正确的是( )| A、电流从右侧电极经过负载后流向左侧电极 |
| B、负极发生的电极反应式为N2H4+4OH--4e-═N2+4H2O |
| C、该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D、该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L 1.0mo1?L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、1mol的羟基与1moL的氢氧根离子所含电子数均为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
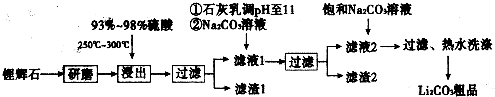
| ||
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
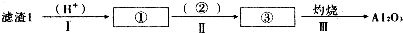
查看答案和解析>>
科目:高中化学 来源: 题型:
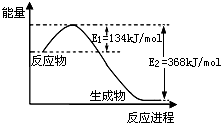
| 温度 | 平衡浓度/(mol L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |
| 成分 | 含量/(mg L-1) | 成分 | 含量/(mg L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
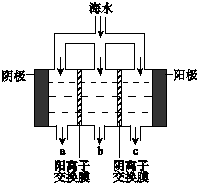 电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.
电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com