
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
分析 (1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平离子方程式;
(2)溶液混合后显示紫红色,当紫红色褪去后计时结束;
(3)实验①和②研究浓度对反应速率的影响,要保证变量单一;
(4)根据规范的操作要求,实验探究的基本原理分析回答;
(5)考虑催化剂对化学反应速率的影响.
解答 解:(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,
故答案为:紫红色刚好褪去;
(3)实验①和②研究浓度对反应速率的影响,高锰酸钾作为指示剂,浓度不变,都是5.0mL,所以V1=5.0,溶液总体积为10.0mL,则V2=10.0-5.0-2.0=3.0,
故答案为:V1=5.0,V2=3.0;
(4)A.实验时可以用量筒量取体积,故A错误;
B.实验时应将5.0mLKMnO4溶液与5.0mL H2C2O4溶液混合后,再将盛有混合液的烧杯置于相应温度的水浴中,立即按下秒表,至反应结束时,按下秒表,记录读数,故B错误;
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性,故C正确;
D.实验①和③对应物质的体积相同,可研究温度对反应速率的影响,故D正确;
故答案为:CD;
(5)从实验数据分析,MnSO4溶液在反应中为催化剂,可能原因为反应生成的Mn2+对反应有催化作用,
故答案为:反应生成的Mn2+对反应有催化作用.
点评 本题考查影响化学反应速率的因素,明确探究影响化学反应速率因素的方法,要认真分析题中信息,得出合理结论,本题难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
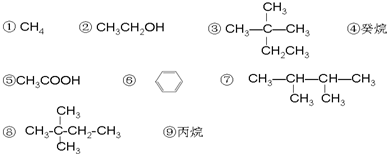
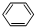 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$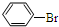 +HBr;
+HBr;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 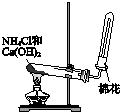 制备并收集氨气 | B. |  制备氯气 | ||
| C. | 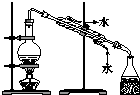 蒸馏海水得到淡水 | D. | 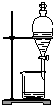 分离Na2CO3溶液与CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 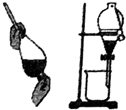 可用于分离苯和水的混合物 | |
| B. | 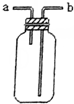 可用于收集H2、NH3、CO2、Cl2、HCl等气体 | |
| C. | 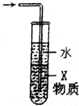 X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 | |
| D. | 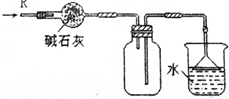 可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 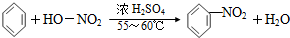 | |
| B. |  | |
| C. | 2 CH3CH2OH+O2 $→_{△}^{催化剂}$ 2 CH3CHO+2 H2O | |
| D. | CH2=CH2+HCl→CH3CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
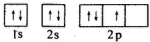
| A. | 洪特规则 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则特例 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com