
| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
分析 A.气体摩尔体积使用对象为气体;
B.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$,结合1个二氧化氮含有2个氧原子解答;
D.气体分子有单原子分子、双原子分子、三原子分子等;
解答 解:A.标况下水是液体,不能使用气体摩尔体积,故A错误;
B.88gC02含有的C02分子数为$\frac{88g}{44g/mol}$×NA=2NA,故B正确;
C.46gNO2气体含有的氧原子数为$\frac{46g}{46g/mol}$×2×NA=2NA,故C错误;
D.气体分子构成未知,无法计算原子个数,如1mol氢气含有2NA个原子,1mol臭氧含有3NA个原子,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,注意明确物质的量与摩尔质量、阿伏伽德罗常数等之间的关系题是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大,


科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 向AlCl3溶液中加入过量的NaOH溶液 Al3++3OH-═Al(OH)3↓ | |
| C. | Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+═6Fe3++H2↑+8H2O | |
| D. | NaHSO4溶液与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16gO2与16gO3体积比为3:2 | |
| B. | 由H2、O2组成的混合气,密度是氢气的8.5倍,混合气中H2的质量分数为50% | |
| C. | 将标况下22.4L的HCl气体溶于1 L水中配制1mol/L的HCl溶液 | |
| D. | 1mL 3mol/L的K2SO4溶液和100mL 1mol/L的Al2(SO4)3溶液,SO42-浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应 | |
| B. | C3H6与C4H8一定互为同系物 | |
| C. | 全降解塑料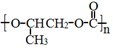 可由环氧丙烷 可由环氧丙烷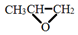 和CO2缩聚制得 和CO2缩聚制得 | |
| D. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,生成水的质量为18(1-a)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度时,HF的Ka增大,水的Kw不变 | |
| B. | 向Mg(OH)2悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大 | |
| C. | 常温下,0.lmol/LNH4Cl 溶液的 pH>7 | |
| D. | 0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(SO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 倾倒液体时试剂瓶标签面向手心. | |
| B. | 玻璃棒蘸取溶液滴到放在表面皿上湿润的pH试纸上. | |
| C. | 用HCl溶液洗涤并灼烧铂丝后,再进行焰色反应. | |
| D. | KOH溶液保存在带磨口玻璃塞的试剂瓶中. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
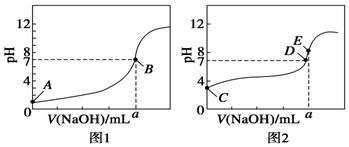 常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.
常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
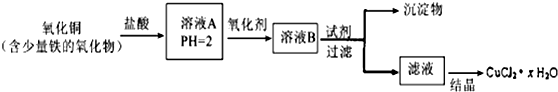
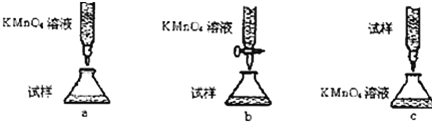
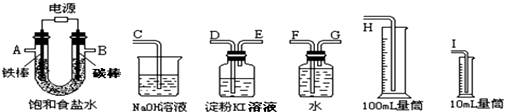
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com