
| 实验序号 | 浓度(mol/L) | 时间(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 温 度 |
8000C | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
| △C |
| △t |
| △C |
| △t |
| (1-0.67)mol/L |
| 20min |
| 0.25×0.25 |
| 0.502 |
| 1 |
| 4 |
| 0.30×0.30 |
| (C3-0.60)2 |
| 1 |
| 4 |
| 1 |
| 0.25 |
| ( 2x)2 |
| (0.5-x)2 |
| 0.25mol/L |
| 0.5mol/L |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、用Zn和2mol?L-1H2SO4反应制取H2时,向溶液中滴加少量CuSO4溶液 |
| B、日常生活中,将食物贮藏在冰箱中 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、用相同质量的锌粉替代锌粒与同浓度、同体积的盐酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 要 求 | 试剂及方法 |
| 除去KI中少量I2 | |
| 鉴别Na2CO3和K2CO3 | |
| 鉴别 SO2和CO2气体 | |
| 判断CH4中是否含有C2H4 | |
| 证明NH3.H2O溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
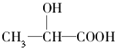 .已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
.已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
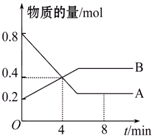 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤是由有机物和无机物组成的复杂的混合物 |
| B、医学上常用CuSO4溶液和NaOH溶液检验糖尿病人尿液中的葡萄糖 |
| C、反应物的总能量高于生成物的总能量时,发生吸热反应 |
| D、甲醛是某些劣质装饰板材释放的常见污染物之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com