
| A. | 该有机物不能发生加成反应,但能发生取代反应 | |
| B. | 该有机物不能使酸性高锰酸钾溶液褪色,但能使溴水褪色 | |
| C. | 该有机物分子中的所有原子可能在同一平面上 | |
| D. | 该有机物的一溴代物最多有11种 |
分析 分子组成为C9H12的苯的同系物,已知苯环上只有一个取代基,取代基的组成为-C3H7,所以取代基为正丙基或异丙基.故该有机物为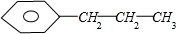 或
或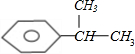 .
.
解答 解:A.该有机物含有苯环,能与氢气发生加成反应,苯环和烷基都可以发生取代反应,故A错误;
B.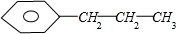 或
或 ,烷基连接苯环的C原子上含有H原子,可以被酸性高锰酸钾氧化,使酸性高锰酸钾溶液褪色,但不能能使溴水褪色,故B错误;
,烷基连接苯环的C原子上含有H原子,可以被酸性高锰酸钾氧化,使酸性高锰酸钾溶液褪色,但不能能使溴水褪色,故B错误;
C.分子中含有甲基,具有甲烷的四面体结构,所有原子不可能在同一平面上,故C错误;
D.若为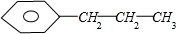 ,一溴代物发生在苯环上取代有3种,发生在丙基上有3种,所以共有6种;
,一溴代物发生在苯环上取代有3种,发生在丙基上有3种,所以共有6种;
若为 ,一溴代物发生在苯环上取代有3种,发生在异丙基上有2种,所以共有5种.所以该有机物的一溴代物最多有11种同分异构体,故D正确.
,一溴代物发生在苯环上取代有3种,发生在异丙基上有2种,所以共有5种.所以该有机物的一溴代物最多有11种同分异构体,故D正确.
故选D.
点评 本题考查同分异构体书写、苯的同系物的性质、分子空间结构等,难度不大,注意B选项中连接苯环的C原子上含有H原子的苯的同系物可以被酸性高锰酸钾氧化.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验方案 | 实验目的 |
| A | 向酸性KMnO4溶液中滴加草酸溶液,观察紫色是否消失 | 验证草酸具有还原性 |
| B | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
| C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
| D | 将Mg(OH)2沉淀转入烧杯中,加足量稀硫酸溶解,加热浓缩,冷却结晶 | 制备硫酸镁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,50g 98%浓硫酸和50g 98%浓磷酸混合后含氧原子数为4NA | |
| B. | 标准状况下,活泼金属与稀硫酸反应转移2NA个电子时,可产生22.4L气体 | |
| C. | 6.4g SO2溶于水配成1L溶液,含有H2SO3的分子数为0.1NA | |
| D. | 1mol C3H6分子中碳碳共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中含有的化学键的类型离子键、共价键
其中含有的化学键的类型离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com