
金属锂是原子能工业和新能源工业中的重要物质。工业上常用β—辉锂矿(主要成分是LiAlSi2O6,含有少量钙、镁杂质)制备金属锂,其生产流程如下:
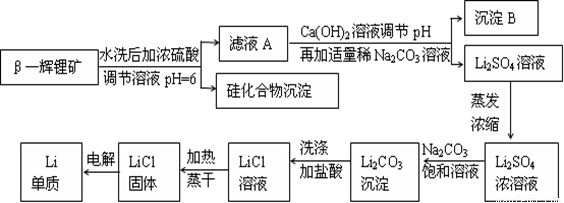
已知Li2CO3微溶于水。请回答下列问题:
(1)写出LiAlSi2O6与硫酸反应的化学方程式_______________________。
(2)沉淀B的主要成分是_____________(写化学式)。
(3)蒸发浓缩Li2SO4溶液时,需要使用的硅酸盐质仪器有蒸发皿、_________和_________。
(4)上述生产流程中蒸发浓缩Li2SO4溶液的目的是____________________。
(5)金属锂用于锂电池时,常用FeF3作其正极的活性物质,FeF3常用FeCl3与40%HF溶液反应制备。在制备过程中需要选用特制聚四氟乙烯材料的容器进行反应,而不是用普通的玻璃仪器或陶瓷仪器,其原因是_________________________________(用化学反应方程式表示)。
(6)金属锂可用于储存氢气,其原理是:①2Li+H2=2LiH,②LiH+H2O=LiOH+H2↑。若已知LiH的密度为0.82g·cm-3,用金属锂吸收224L H2(标准状况)恰好完全反应,则生成的LiH的体积与被吸收的氢气的体积之比为1: ______(精确到整数)。
(1) 2LiAlSi2O6+4H2SO4=Li2SO4+Al2(SO4) 3+4H2SiO3↓(2分)。
(2) Al(OH)3和CaCO3 (2分) (3)酒精灯(1分) 玻璃棒(1分)。
(4)碳酸锂微溶于水,蒸发浓缩的目的是增大溶液中锂离子浓度,使锂离子浓度与碳酸根离子浓度之积大于Ksp(Li2CO3),以便产生碳酸锂沉淀。(3分)
(5)SiO2+4HF=SiF4↑+2H2O(2分)。(6) 1148(2分)。
【解析】
试题分析:β—辉锂矿溶于硫酸生成硫酸锂、硫酸铝、和硅酸沉淀,过滤除去硅酸,滤液中加入Ca(OH)2和Na2CO3后生成CaCO3和Al(OH)3就是沉淀B,过滤,得到硫酸锂溶液,蒸发浓缩后,加入Na2CO3得到Li2CO3沉淀,加盐酸得到LiCl,电解得锂。(6)吸收氢气10摩尔,生成LiH20摩尔,质量是160克,体积是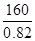 毫升,氢气体积22400毫升,体积比为1:1148
毫升,氢气体积22400毫升,体积比为1:1148
考点:考查化工流程,基本实验操作、化学方程式书写,物质的量计算


科目:高中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
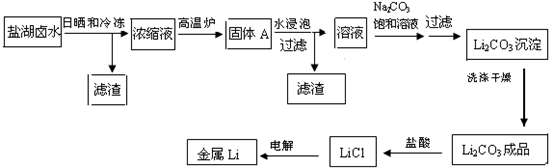
锂在原子能工业中具有十分独特的地位,被誉为“高能金属”,它推动着能源工业,尤其是电池技术的发展。盐湖卤水中锂的含量较高,资源丰富,提炼锂的价格低廉,成为国内外开发生产锂的主攻方向。把盐湖卤水自然日晒和冷冻,从卤水中析出食盐、泻利盐、钾盐镁矾和光卤石等一系列盐类,得到富含MgC12的浓缩母液,其中LiC1的浓度达10%以上。把浓缩母液经高温炉分解除去MgC12等一系列过程,最终得到金属锂。其主要生产工艺流程如下:
 已知:Li2CO3在不同温度的溶解度如下表:
已知:Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)写出浓缩母液在高温炉中分解的化学方程式
(2)写出盐酸与Li2CO3反应的离子方程式
(3)洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)熔融LiCl电解的环境是
a.氢气中b.氮气中c.空气中d.真空中e.He气
查看答案和解析>>
科目:高中化学 来源: 题型:
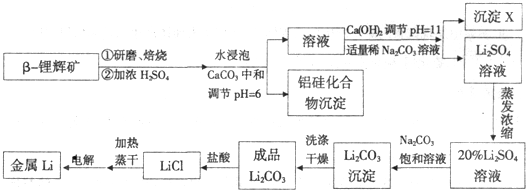
(共8分)锂在原子能工业中具有十分独特的地位,被誉为“高能金属”,它推动着能源工业,尤其是电池技术的发展。盐湖卤水中锂的含量较高,资源丰富,提炼锂的价格低廉,成为国内外开发生产锂的主攻方向。把盐湖卤水自然日晒和冷冻,从卤水中析出食盐、泻利盐、钾盐镁矾和光卤石等一系列盐类,得到富含MgC12的浓缩母液,其中LiC1的浓度达10%以上。把浓缩母液经高温炉分解除去MgC12等一系列过程,最终得到金属锂。其主要生产工艺流程如下:
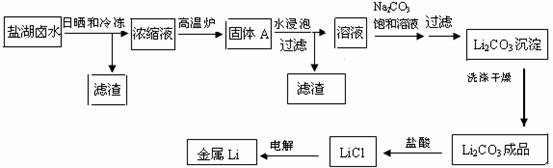 已知:Li2CO3在不同温度的溶解度如下表:
已知:Li2CO3在不同温度的溶解度如下表:
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)写出浓缩母液在高温炉中分解的化学方程式
(2)写出盐酸与Li2CO3反应的离子方程式
(3)洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)熔融LiCl电解的环境是
a.氢气中b.氮气中c.空气中d.真空中e.He气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com