
(14分,每空2分)某化学兴趣小组为了探究:在常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1: ;猜想2 ;猜想3 。
为了验证猜测,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入, :

(1)B中应该装下列 试剂(填编号);
A.NaCl溶液 B.KMnO4溶液 C.盐酸 D.澄清石灰水
(2)A中品红的作用是: ;
(3)D中澄清石灰水的作用是: 。
通过该实验,小组同学观察到以下三个实验现象:
①A中品红褪色 ②C中品红不褪色 ③D中澄清石灰水变浑浊
【得出结论】
由上述现象小组同学确认该气体的成分是 。
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
(14分,每空2分)已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X 原子的电子层数与它的核外电子总数相同,而Z 原子的最外层电子数是次外层的三倍,Y 与 Z 可以形成两种以上的气态化合物,则
(1)X 是——————————、Y是———————————、Z是———————————(均用元素名称填写)
(2)由Y 和 Z 组成,且Y和 Z的质量比为7:12的化合物的化学式(分子式)是 _____
(3)由X、Y、Z中的两种元素组成,且与X2Z 分子具有相同电子数的两种离子是 _____ ————————和 _____ —————————(填离子符号)
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4 :2 :3 ,该盐的化学式是 _____ ——————————————————。—
查看答案和解析>>
科目:高中化学 来源:2012届河南省三门峡市高三上学期调研考试化学试卷 题型:填空题
(14分,每空2分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应
6NO2+ 8NH3 7N2+12
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2 (g)
(g) 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
①写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明 反应达到平衡状态的是 。
反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省永安一中高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5 L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密 闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。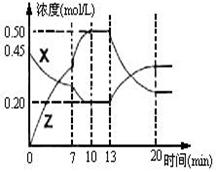
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是  __(填序号)
__(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三第一学期期中考试化学试卷 题型:实验题
(14分,每空2分)某试剂厂用银(含杂质铜)和硝酸(含Fe3+)反应制取硝酸银,步骤如下: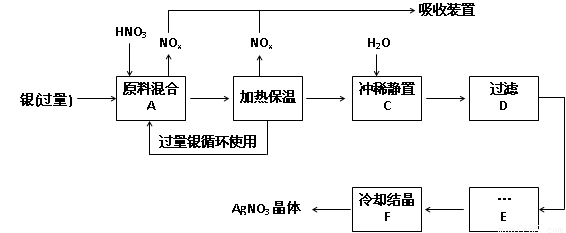
(1)工业上一般选用中等浓度的硝酸和银反应来制取硝酸银。请在下表空格处填空。
|
|
优点 |
缺点 |
|
使用浓硝酸 |
反应速率快 |
酸耗较大,产生NOx的量较多 |
|
使用稀硝酸 |
|
|
(2)步骤B加热保温的作用是 :
a. 有利于加快反应速率
b.有利于未反应的硝酸挥发
c.有利于硝酸充分反应,降低溶液中H+的浓度
(3)步骤C是为了除去Fe3+、Cu2+等杂质,冲稀时产生沉淀的原因是 ;
(4)步骤C中加水的量应该适量,若加入过多的水,对后续步骤造成的不良影响是:
;
(5)步骤E进行的操作是 。
(6)制得的硝酸银中含有少量硝酸铜,通常除去硝酸铜的方法是在步骤E之前加适量新制的Ag2O,使Cu2+转化为Cu(OH)2沉淀,反应后过滤除去。该反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年学福建省高二上学期期中考试化学试卷 题型:填空题
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应 进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
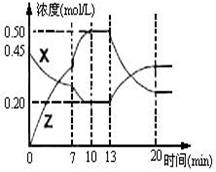
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温
④降温 ⑤使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com