
| 1000ρω |
| M |
| 1000ρω |
| M |
| 3×40 |
| 1000×1.12 |
| 0.2mol |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用粮食酿酒的过程中,不可能生成乙酸 |
| B、乙醇和乙酸互为同分异构体 |
| C、氨基酸、蛋白质和纤维素均属于高分子化合物 |
| D、乙烯能使溴的四氯化碳溶液褪色,与乙烯分子含有碳碳双键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
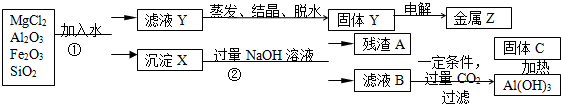
 金属冶炼和处理常涉及许多反应.
金属冶炼和处理常涉及许多反应.查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)肼(N2H4)又称联氨,在常温下是一种液态燃料,可用作火箭燃料.已知在25℃时,101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量,表示N2H4燃烧热的热化学方程式是
(1)肼(N2H4)又称联氨,在常温下是一种液态燃料,可用作火箭燃料.已知在25℃时,101kPa时,1gN2H4在氧气中完全燃烧生成氮气和H2O,放出19.5kJ热量,表示N2H4燃烧热的热化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等于9.2 mo1/L |
| B、小于 9.2 mo1/L |
| C、大于 9.2 mo1/L |
| D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,1molH2O的体积约为22.4L |
| B、1L1mol/L的CaCl2溶液中含Cl-的数目为NA |
| C、在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA |
| D、标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-) |
| c(Na+) |
| A、升温 |
| B、加水稀释 |
| C、加少量的KOH固体 |
| D、加少量固体Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com