
 铜及其化台物在工业、农业、科技和日常生活中有广泛应用.
铜及其化台物在工业、农业、科技和日常生活中有广泛应用.分析 (1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,结合原子守恒和电荷守恒配平书写;
(2)发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+):n(NO3-)=4:1,溶解的Cu最多,结合反应计算;
(3)①由图象生成4 mol固态氧化铜放出(a+b)kJ的热量可知,以此书写反应过程中的热化学方程式;
②由化学方程式灼烧后质量不变,反应的氧气和生成的二氧化碳和水的质量相同,结合金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%计算;
(4)①硫化铜与氧气在淋滤作用下生成硫酸铜;
②硫化铜溶解度小于硫化锌,硫酸铜溶液遇到闪锌矿发生沉淀转化反应生成硫化铜.
解答 解:(1)辉铜矿(主要成分是Cu2S)冶炼铜,和酸性高锰酸钾溶液反应生成铜离子,硫酸根离子,高锰酸根离子被还原为锰离子,反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O,故答案为:Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O;
(2)设含有c(HNO3)=xmol•L-1,c(H2SO4)=ymol•L-1的废酸混合液100mL,由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,n(H+):n(NO3-)=4:1,溶解的Cu最多,则$\left\{\begin{array}{l}{x+y=0.6}\\{\frac{x+2y}{x}4}\end{array}\right.$,解得x=0.24mol/L,则溶解的Cu为$\frac{0.24mol/L×0.1L×3}{2}$=0.036mol/L,所以所得溶液中Cu2+的物质的量浓度最大值为$\frac{0.036mol/L}{0.1L}$=0.36mol/L,
故答案为:0.36mol/L;
(3)①由图象可知:①4Cu(s)+O2(g)=2Cu2O(s)△H=-akJ/mol,②2Cu2O(s)+O2(g)=4CuO(s)△H=-bKJ/mol;
由盖斯定律计算(①+2)×$\frac{1}{4}$得到Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-$\frac{(a+b)}{4}$kJ•mol-1;
故答案为:Cu(s)+$\frac{1}{2}$O2(g)=CuO(s)△H=-$\frac{(a+b)}{4}$kJ•mol-1;
②含有铜绿的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同,说明反应的氧气质量和生成的二氧化碳、水蒸气的质量相同计算得到,设铜绿中铜物质的量为x,铜绿物质的量为y,
2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
x 0.5x
Cu2(OH)2CO3$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+CO2+H2O
y y y
0.5x×32=18y+44y
x:y=31:8,
由元素守恒可知,金属生锈率=$\frac{已生锈的金属质量}{金属的总质量}$×100%=$\frac{2y×64}{(2y+x)×64}$×100%=$\frac{2×\frac{8}{31}x×64}{(2×\frac{8}{31}x+x)×64}$×100%=34%,
故答案为:34%;
(4)①硫化铜与氧气在淋滤作用下生成硫酸铜,反应的化学方程式为:CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4 ,故答案为:CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4 ;
②渗透到地下深层的硫酸铜溶液遇到闪锌矿,在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生),硫化铜溶解性小于硫化锌,发生沉淀转化反应,反应的离子方程式:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq),
故答案为:Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物(或在相同条件下,由于KSP(CuS)小于KSP(ZnS),故反应可以发生).
点评 本题考查较综合,涉及离子反应、化学方程式计算、沉淀转化原理等,综合性较强,侧重化学反应原理及分析与应用能力的考查,(2)中计算为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 除去Cl2中的HCl | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
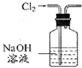 | 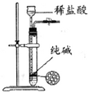 | 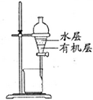 | 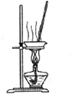 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
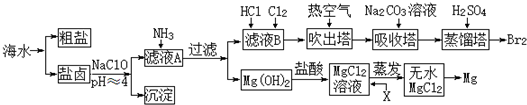
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
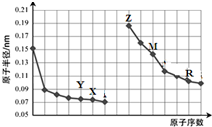
| A. | 简单离子的半径大小比较:Y>X>Z | |
| B. | 气态氢化物稳定性:X>R | |
| C. | R最高价氧化物对应水化物中既有离子键又有共价键 | |
| D. | Z单质能从M的盐溶液中置换出单质M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子) .
. .
. .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
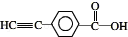
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).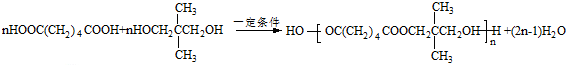 .
.
 .
.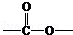 基团
基团 查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )
在2L密闭容器中有X、Y、Z三种气体间恒温下发生的可逆反应,它们的物质的量随时间变化而变化的曲线如图所示.下列分析正确的是( )| A. | 4 min内 v(Z)=0.025 mol•L-1•min-1 | |
| B. | Y的平衡转化率为75% | |
| C. | 平衡常数K=(25/12)(mol•L-1)-2 | |
| D. | t1 min时充入少量He,平衡向正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 放电时,OH-向镍电极作定向移动 | |
| B. | 放电时,负极的电极反应为:H2-2e-+2OH-═2H2O | |
| C. | 充电时,将电池的碳电极与外电源的正极相连 | |
| D. | 充电时,阴极的电极反应为:Ni(OH)2+OH--e-═NiO(OH)+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com