
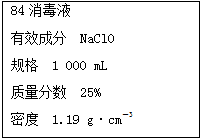
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: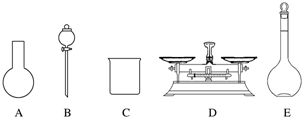
分析 (1)根据含25%NaClO、1000mL、密度1.19g•cm-3,结合c=$\frac{1000ρw}{M}$来计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)根据溶液的配制及c=$\frac{n}{V}$、m=nM来分析;
(4)①根据c(H2SO4)=$\frac{1}{2}$c(H+)计算;
②根据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)c(NaClO)=c=$\frac{1000ρw}{M}$=$\frac{1000×1.19×25%}{74.5}$=4.0 mol•L-1,故答案为:4.0;
(2)稀释后c(NaClO)=$\frac{1}{100}$×4.0 mol•L-1=0.04 mol•L-1,故答案为:0.04;
(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol•L-1×74.5 g•mol-1=149 g,故D错误;
故答案为:C.
(4)①c(H2SO4)=2.3mol•L-1,则c(H+)=4.6mol•L-1,故答案为:4.6;
②溶液稀释前后溶质的物质的量不变,浓硫酸的浓度为c=$\frac{1000×1.84×98%}{98}$=18.4mol/L,假设需要浓硫酸的体积为V,
则V×18.4mol/L=2L×2.3mol/L,V=0.25L=250mL,
故答案为:250.
点评 本题考查物质的量浓度的计算以及溶液的配制,为高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 两个反应均为氧化还原反应 | |
| B. | CO2与SO2不能用澄清石灰水鉴别 | |
| C. | CO2分子中各原子最外层均为8电子稳定结构 | |
| D. | 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g)△H=+270kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA | |
| B. | 常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为 NA | |
| C. | 50 mL 18.4 mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ①②③⑥ | C. | ②③④⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有⑤ | C. | ③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com