
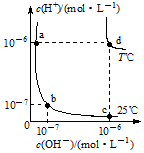
 不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.回答下列问题:
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示.回答下列问题:分析 (1)根据T℃时Kw值判断;
(2)醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性;
(3)d点对应溶液中氢离子浓度为10-6mol/L,氢离子浓度与氢氧根离子浓度相同;
(4)酸溶液中水电离的氢离子浓度等于水电离的氢氧根离子浓度;将此溶液稀释至原体积的1000倍,氢离子浓度约为10-6mol/L,硫酸根离子的浓度变为原来的$\frac{1}{1000}$;加入T℃的pH=7的NaOH溶液恰好使溶液呈中性,则溶液中溶质为硫酸钠,根据原子守恒计算.
解答 解:(1)T℃时Kw=10-6×10-6=10-12,该温度下的Kw值大于25℃时的Kw,所以T℃>25℃;
故答案为:>;
(2)醋酸与NaOH恰好反应生成醋酸钠,溶液显碱性,若要溶液显中性,则醋酸稍过量,所以醋酸与NaOH的体积不相等;
故答案为:不相等;
(3)d点对应溶液中氢离子浓度为10-6mol/L,则溶液的pH=6,氢离子浓度与氢氧根离子浓度相同,所以溶液显中性;
故答案为:6;中性;
(4)T℃时pH=5的硫酸溶液100mL中,由水电离的c(H+)=$\frac{1{0}^{-12}}{1{0}^{-5}}$=10-7mol/L;将此溶液稀释至原体积的1000倍,氢离子浓度约为10-6mol/L,硫酸根离子的浓度变为原来的$\frac{1}{1000}$,则稀释后溶液中$\frac{c({H}^{+})}{c(S{O}_{4}^{2-})}$=$\frac{1{0}^{-6}}{\frac{1}{2}×1{0}^{-5}×\frac{1}{1000}}$=200;加入T℃的pH=7的NaOH溶液恰好使溶液呈中性,则溶液中溶质为硫酸钠,n(Na+)=2n(SO42-),由原子守恒可知,所加n(Na+)=2×$\frac{1}{2}$×10-5×0.1=10-6mol,c(NaOH)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5mol/L,则V(NaOH)=$\frac{1{0}^{-6}mol}{1{0}^{-5}mol/L}$=0.1L=100mL;
故答案为:10-7mol/L;200;100.
点评 本题考查了离子积常数、溶液pH的计算等知识点,注意离子积常数只与温度有关、与溶液浓度及酸碱性无关,题目难度不大,T℃酸溶液稀释后溶液中的氢离子浓度降到10-6mol/L即不再下降,但硫酸根会一直降低.


科目:高中化学 来源: 题型:选择题
| A. | 钠在空气中燃烧,发出黄色火焰 | |
| B. | 钠在空气中燃烧,产物是Na2O | |
| C. | 钠是银白色金属,硬度大,熔点高 | |
| D. | 取用金属钠时,剩余的钠不能放回原瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子式: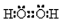 | |
| B. | 次氯酸分子的结构式:H-Cl-O | |
| C. | 乙醇的分子式:C2H5OH | |
| D. | 1,1-二溴乙烷的结构简式:CH3CHBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水:2Na+2H2O═2Na++2 OH-+H2↑ | |
| B. | CaCO3与稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | FeCl3溶液与Fe反应:Fe3++Fe═2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 | ||
| C. | a=b | D. | 2b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代反应 | B. | 水解反应 | C. | 加聚反应 | D. | 缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
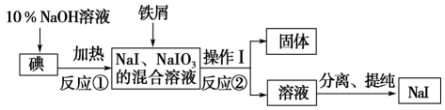
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com