
| A. | Al2O3 $\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{蒸发}{→}$无水AlCl3 | |
| B. | Mg(OH)2$\stackrel{盐酸}{→}$MgCl2(aq)$\stackrel{电解}{→}$Mg | |
| C. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | AgNO3(aq)$\stackrel{NH_{3}•H_{20}}{→}$Ag(NH3)2OH(aq)$→_{△}^{蔗糖}$Ag |
分析 A、氧化铝是两性氧化物,与盐酸反应生成氯化铝,氯化铝与酸性溶液中蒸干得到无水氯化铝;
B、电解氯化镁溶液得不到单质镁;
C、Si可与氯气在高温下反应生成SiCl4,SiCl4可与氢气发生反应生成Si和HCl;
D、蔗糖为非还原性糖,与银氨溶液不反应.
解答 解:A、氧化铝是两性氧化物,与盐酸反应生成氯化铝,氯化铝与酸性溶液中蒸干得到无水氯化铝,所以转化关系可以实现,故A符合;
B、电解氯化镁溶液得不到单质镁,得到氢氧化镁,故B不符合;
C、Si可与氯气在高温下反应生成SiCl4,SiCl4可与氢气发生反应生成Si和HCl,该反应可用于工业提纯硅,故C符合;
D、蔗糖为非还原性糖,与银氨溶液不反应,故D不符合;
故选AC.
点评 本题考查了物质性质的分析应用,主要是反应产物和反应条件的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 13 | B. | 15 | C. | 14 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6L 氯气与27g铝充分反应,转移的电子数目为3NA | |
| B. | 1mol羟基中含有10NA | |
| C. | 1molCH3COONa和少量CH3COOH溶于水所得的中性溶液中,CH3COO-的数目为NA | |
| D. | 1mol O2作氧化剂时转移的电子数目一定为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物 CH4 和CH3OH,不论以何种比例混合,混合物完全燃烧后,产生的水和二氧化碳的分子数比为2:1 | |
| B. | 为了除去甲烷中含有的少量乙烯气体,将混合气体通过酸性高锰酸钾溶液中洗气,可以得到纯净的甲烷气体 | |
| C. | 将a g CH2O、H2以及CO的混合气体在氧气中完全燃烧的产物,通过足量的过氧化钠固体,充分反应后,固体增重也是a g | |
| D. | 实验室制取乙炔时,可将生成的气体通过硫酸铜溶液,除去可能存在的H2S等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取1.06g无水Na2CO3,加入100mL容量瓶中溶解,定容 | |
| B. | 需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管 | |
| C. | 定容时俯视容量瓶刻度线,浓度偏高 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
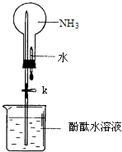 某学习小组欲制取氨气并探究其性质.请回答:
某学习小组欲制取氨气并探究其性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
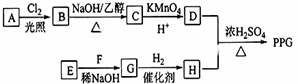

 .
. .
.
 (写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).
(写结构简式)D的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是有有c(填标号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com