
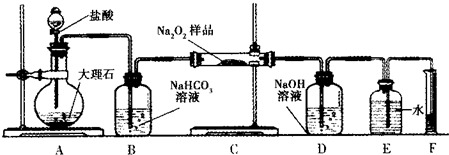
分析 (1)过氧化钠在空气中变质会最后生成碳酸钠固体,依据碳酸根离子检验是否变质;
(2)①依据装置图分析可知,测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好;
②装置C中是二氧化碳和过氧化钠反应生成碳酸钠和氧气的反应;
③依据量筒读取液体体积时需要和集气瓶液面向平,温度在常温下;
④依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
解答 解:(1)过氧化钠在空气中变质会最后生成碳酸钠固体,探究一包过氧化钠样品是否已经变质,可以利用碳酸根离子和钡离子结合生成碳酸钡白色沉淀证明Na2O2已经变质;
故答案为:BaCl2;
(2)①实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;
故答案为:检查装置的气密性;
②装置C中是二氧化碳和过氧化钠反应生成碳酸钠和氧气的反应,反应的化学方程式为:2CO2+2Na2O2=2Na2CO3+O2;
故答案为:2CO2+2Na2O2=2Na2CO3+O2;
③a.直接读取气体体积,不冷却到室温,会使溶液体积增大,读出结果产生误差,故a不正确;
b.调整量筒内外液面高度使之相同,使装置内压强和外界压强相同,避免读取体积产生误差,故b正确;
c.视线与凹液面的最低点相平读取量筒中水的体积是正确的读取方法,故c正确;
故答案为:bc;
④测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量=$\frac{V×1{0}^{-3}L}{22.4L/mol}$,则样品中过氧化钠的质量分数为=$\frac{\frac{V×1{0}^{-3}L}{22.4L/mol}×2×78g/mol}{ag}$×100%=$\frac{39V}{56a}$%;
故答案为:$\frac{39V}{56a}$%.
点评 本题考查了物质组成的实验探究方法,实验设计方法,实验计算应用,装置图的分析判断是解题关键,题目难度中等,侧重于考查学生的分析能力和实验探究能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 单质分子中都存在非极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 乙醇分子中只存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 显酸性 | B. | 显碱性 | ||
| C. | 显中性 | D. | 不能确定其酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
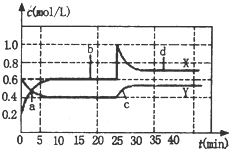 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气都是化石燃料,都是非再生能源,都是一级能源 | |
| B. | 电能、水煤气、氢气都是二级能源,要靠其他能源才能制取 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 凡含有食品添加剂的食物对人体均有害,不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时OH-向正极移动 | B. | 放电时正极上有氢气生成 | ||
| C. | 水既是氧化剂又是溶剂 | D. | 总反应为:2Li+2H2O═2LiOH+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com