

分析 (1)常温下,铁和浓硫酸发生钝化现象;
(2)①亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,标况下二氧化硫体积=0.01mol×22.4L/mol=224mL;
(3)品红溶液能检验二氧化硫存在;
(4)碳和浓硫酸反应生成二氧化碳,所以Q为CO2,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳;
(5)氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色;
(6)空气中含有水蒸气和二氧化碳,影响氢气、二氧化碳的检验.
解答 解:(1)常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以将铁钉放入浓硫酸片刻无明显变化的原因是铁钉表面被钝化,故答案为:铁钉表面被钝化(或其他合理答案);
(2)①a.氯水能将亚铁离子氧化为铁离子,铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故错误;
b.铁粉和酸反应生成亚铁离子,不能确定原来溶液中是否含有亚铁离子,故错误;
c.浓氨水和亚铁离子反应生成氢氧化亚铁沉淀,氢氧化亚铁能被氧化生成氢氧化铁红褐色沉淀,不能确定溶液中一定含有亚铁离子,故错误;
d.亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,故正确;
故选d;
②根据SO2+Br2+2H2O═2HBr+H2SO4知,二氧化硫被氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀,所以2.33g沉淀是BaSO4,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,根据S原子守恒得n(BaSO4)=n(S)=n(SO2)=0.01mol,标况下二氧化硫体积=0.01mol×22.4L/mol=224mL,二氧化硫体积分数=$\frac{224mL}{336mL}×100%$=66.7%,
故答案为:66.7%;
(3)品红溶液能检验二氧化硫存在,所以该装置的作用是检验SO2是否除尽,故答案为:检验SO2是否除尽;
(4)碳和浓硫酸反应生成二氧化碳,所以Q为CO2,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳,故选c;
(5)氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果Y中含有氢气,预计实验现象是D中固体由黑变红,E中固体由白变蓝,故答案为:D中固体由黑变红,E中固体由白变蓝;
(6)空气中含有水蒸气和二氧化碳,影响氢气、二氧化碳的检验,所以该装置作用是防止空气中的CO2和水蒸气进入装置E中,
故答案为:防止空气中的CO2和水蒸气进入装置E中.
点评 本题考查性质实验方案评价,为高频考点,明确实验原理是解本题关键,知道每个装置可能发生的反应及其作用,难点是判断碱石灰作用,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 共包含18种元素 | B. | 前3周期元素 | ||
| C. | 除稀有气体外,Cl的原子半径最大 | D. | 仅含5种金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中都存在化学键 | |
| B. | 晶体内部的微粒在空间的排列均服从紧密堆积原理 | |
| C. | 任何晶体中,若有阴离子必定含有阳离子 | |
| D. | 金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
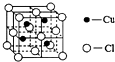 铜是过渡金属元素,可以形成多种化合物.
铜是过渡金属元素,可以形成多种化合物.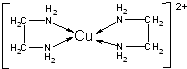
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
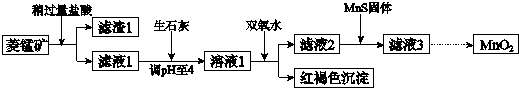
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
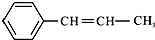 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 不溶于水,易溶于有机溶剂 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色 | |
| C. | 能发生聚合反应,其产物可表示为: | |
| D. | 能使溴水褪色,但不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
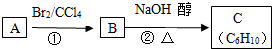
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com