
| A、配制50mL1 mol?L-1NaCl溶液时,选用100mL的容量瓶 | B、氯气液化后贮存于钢瓶中 | C、干燥气体时,可选用干燥器或U型管 | D、用碱式滴定管量取20.00mL的酸性KMnO4溶液 |


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源:2013-2014学年福建省福州市高三上学期期末质量检测化学试卷(解析版) 题型:选择题
下列各实验相应操作、实验现象及原因解释或推论合理的是
选项操作现象解释或推论
A铁片投入浓硫酸无明显变化常温下铁不与浓硫酸反应
B将浓硫酸滴到白纸上白纸变黑浓硫酸强氧化性导致纸张中的纤维素炭化
C二氧化硫通入溴水溴水褪色说明二氧化硫具有漂白性
D湿润的PH试纸检验某气体试纸变蓝该气体是氨气
查看答案和解析>>
科目:高中化学 来源:山西省月考题 题型:实验题
查看答案和解析>>
科目:高中化学 来源:0101 期中题 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:
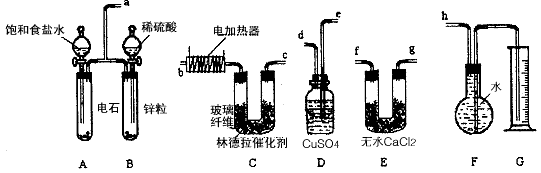
已知使用林德拉催化剂(Pd/PbO、CaCO3)可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示的仪器组装而成的实验装置(铁架台未画出),由乙炔制得乙烯,并测定在氢化反应中乙炔的转化率。若用含0.020 mol CaC2的电石和含1.30 g锌的锌粒(杂质不与酸反应)分别与足量的饱和食盐水和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水的体积为V mL(忽略乙炔在水中溶解的部分)。试回答下列问题:
(1)各装置的连接顺序为
a→_________→_________→_________→_______→_______→_______→h。
(2)写出C中所发生反应的化学方程式:
______________________________________________________________。
(3)装置A中产生气体的反应速率往往太快,为了减慢反应速率,操作时还应采取的措施是
___________________________________________________ _。
(4)装置D的作用 。
(5)G所选用的量筒的容积较合理的是______________(填写选项字母)。
A.500 mL B.1000 mL C.1500mL
(6)若V=672(导管内气体体积忽略不计),
则乙炔的转化率为_________ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com