
| A、水电离出的c(H+):①=②=③=④ | B、将②、③溶液混合后pH=7,消耗溶液的体积:②>③ | C、将等体积的①、②溶液分别与足量铝粉反应,生成H2的量①更多 | D、分别向等体积的四种溶液中加水稀释至100 mL后,溶液的pH:③>④>①>② |


科目:高中化学 来源: 题型:
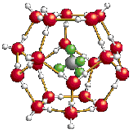 我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:
我国在青藏高原发现大储量可燃冰.可燃冰的晶体结构模型如图:查看答案和解析>>
科目:高中化学 来源: 题型:
[s1] 如图所示,甲容器容积固定不变,乙容器有可移动的
活塞。甲中充入2mol SO2和1 mol O2,已中充入
2 mol SO2和1mol He,在恒定温度和催化剂相同的
|
A.若活塞固定在3处不动,达平衡时两容器
中的压强相等
B.若活塞固定在3处不动,达平衡时两容器
SO3的浓度相等
C.若活塞固定在4处不动,达平衡时两容器
SO3的物质的量分数相等
D.若活塞固定在5处不动,达平衡时乙容器中SO2的物质的量最小
[s1]14.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com