
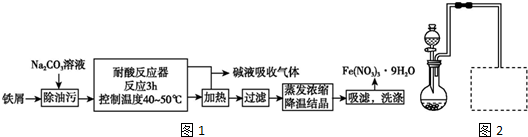
���� ��1����м���ȵ�̼������Һ��ȥ���ۣ�������ϡ���ᷴӦ������ΪFe3+��NO����������Һ���ɫ��������ɫ���壬NO���ܱ��������������������ɶ���������������ü�Һ���գ����ɵ�Fe��NO3��3��Һ��������Ũ�������½ᾧ����20% HNO3ϴ�ӣ��ɵõ�Fe��NO3��3•9H2O��
��2����ȡFe��NO3��3•9H2O��Ҫ���Ƶ��¶�Ϊ40-50�棬ˮԡ���ȸ������ƣ��������ᷴӦ���е�������������������������ж������ŵ������У�����Ҫ�÷�������β������װ�ã���NaOH��Һ���գ��ݴ˻�װ��ͼ��
��� �⣺��1����̼��������Һ��ˮ���Լ��ԣ����Գ����ۣ���ˮ������ӷ���ʽΪ��CO32-+H2O?HCO3-+OH-��
�ʴ�Ϊ��CO32-+H2O?HCO3-+OH-��
�ڽ��������Ժ�ϡ���ᷴӦ������������һ��������ˮ����������Һ��ʾ��ɫ��һ������������������Ϊ������������ɫ�����壬Ҫ�Ƶ�Fe3+���ʼ�������۵������ܹ��������������Fe2+����Ӧ���в������ݵ��������Ա�����ֹͣ������м��
�ʴ�Ϊ����м�ܽ⣬��Һ��Ϊ��ɫ������ɫ�����������Һ���������Ϊ����ɫ����Ӧ���в������ݵ��������Ա�����
��Fe��NO3��3•9H2O������ˮ���������ᣬ�Ƶõ�Fe��NO3��3•9H2O��20%HNO3ϴ�ӵ�Ŀ����ϴȥ�����������ʣ����پ�����ģ�
�ʴ�Ϊ��ϴ�ӳ�ȥ������渽�ŵ����ʣ���20%HNO3ϴ�ӿɽ���ϴ�ӹ����о������ģ�
������Ũ�������½ᾧ�IJ�������������������̨������Ȧ�����ƾ��ơ�����������������ǯ��
�ʴ�Ϊ������̨������Ȧ���������Ǽܣ����ƾ��ơ�����������������ǯ��
��2������ȡFe��NO3��3•9H2O��Ҫ���Ƶ��¶�Ϊ40-50�棬ˮԡ���ȸ������ƣ����Ը�ʵ���ж�Բ����ƿ���ȵ���ѷ�ʽ��ˮԡ���ȣ�
�ʴ�Ϊ��ˮԡ��
�������ӷ����ӷ���������������ó�����������������߷�Ӧ��������ʣ�ͬʱ���������ã�
�ʴ�Ϊ������������������
���������ᷴӦ���е�������������������������ж������ŵ������У�����Ҫ�÷�������β������װ�ã���NaOH��Һ���գ�����װ��ͼΪ ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼���������Ʊ�ʵ�����ƺͷ�������Ŀ�漰��֪ʶ��϶࣬������ʵ�������ͷ��������Ŀ��飬ע����������еķ�Ӧ�����ͷ�Ӧʵ�������ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Cl2��Ӧ���������ᷴӦ�����ɵĽ����Ȼ���һ����ͬ | |
| B�� | Na2O��O2�����Ԫ����ͬ����CO2��Ӧ�IJ���Ҳ��ͬ | |
| C�� | ������ˮ�����ԣ�����ʱ�������ݲ�������������Cl2 | |
| D�� | ��Ư����Һ�м�������ϡ���ᣬ��������Һ��Ư������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�����ԭ�Ӿ��� | B�� | ��ԭ�Ӽ۲�����Ų���2s22p3 | ||
| C�� | �Ȼ�������ڼ�����С��109��28? | D�� | �Ȼ���ˮ��õ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
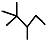 C8H18�� ��2��
C8H18�� ��2��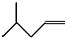 C6H12��
C6H12�� C5H10Br2�� ��4��
C5H10Br2�� ��4��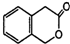 C9H8O2��
C9H8O2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
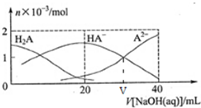 25���£���20mL0.1mol/LH2A��Һ�еμ�0.1mol/LNaOH ��Һ���й��������ʵ����ı仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������
25���£���20mL0.1mol/LH2A��Һ�еμ�0.1mol/LNaOH ��Һ���й��������ʵ����ı仯��ͼ��ʾ�������й�˵����ȷ���ǣ�������| A�� | H2A ���뷽��ʽ H2A�T2H++A2- | |
| B�� | V[NaOH��aq��]=20mL ʱ����Һ�Լ��� | |
| C�� | ��֪25��ʱ K2��H2A��=1.0��10-9.1����V[NaOH��aq��]=VmL ʱ��pH=9.1 | |
| D�� | V[NaOH��aq��]=20mLʱʱ����Һ�д��ڹ�ϵ����HA-��+C��A2-��+C��H2A��=0.1mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������KMnO4������ױ� | |
| B�� | �õ�ˮ������� | |
| C�� | �����յķ��������˿������˿ | |
| D�� | ����ˮ����CH2�TCHCHO�д���̼̼˫�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 8�� | B�� | 10�� | C�� | 13�� | D�� | 16�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2+2H++SO42-�TBaSO4��+2H2O | |
| B�� | Ba2++2OH-+2H++SO42-�TBaSO4��+2H2O | |
| C�� | Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| D�� | OH-+H+�TH2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com