
分析 (1)依据用固体配制溶液的一般步骤为计算、称量、溶解转移、洗涤转移、定容摇匀分析;
(2)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器来分析解答;
(3)具体分析操作对溶质的物质的量及溶液体积的影响,根据c=$\frac{n}{v}$判断误差;
①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,冷却后溶液体积小于500ml;
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml;
③配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变.
解答 解:(1)配制1.00mol/L的NaCl溶液500mL,操作步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,
故答案为:②称量,④移液;
(2)用氯化钠固体配制1.00mol•L-1的NaCl溶液500mL,操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,冷却后转移到500ml容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500ml容量瓶、胶头滴管,故还需要500ml容量瓶、烧杯、玻璃棒、胶头滴管完成该实验,
故答案为:500mL; 烧杯、玻璃棒;
(3)①(3)①未降至室温时,立即将溶液转移至容量瓶定容.溶液热胀冷缩,恢复到室温后溶液体积小于500ml,浓度偏高
故答案为:A;
②盖倒转摇匀后,发现溶面低于刻度线,一部分溶液留在瓶塞与瓶口之间,又滴加蒸馏水至刻度,使溶液体积大于500ml,溶液浓度偏低.
故答案为:B;
③配制前容量瓶用水洗涤后未进行干燥处理,对溶质的物质的量、最终溶液的体积都无影响,所以不影响溶液浓度,
故答案为:C.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理和实验步骤是解题关键,题目难度不大,试题培养了学生的分析能力及化学检验能力.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:实验题
(1)选择仪器。完成本实验所必需的仪器有:托盘天平 药匙、烧杯、玻璃棒、____________、____________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体____________g。
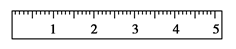
(3)称量。天平调平之后,应将天平的游码调至某个位置,请在下图中用一根 竖线标出游码左边缘所处的位置:
(4)将药品倒入烧杯中溶解、冷却。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯和玻璃棒2~3次是为了_____________
(6)定容、摇匀。
(7)将配好的溶液倒入指定的试剂瓶,并贴好标签,注明溶液名称及浓度。
(8)配制时下列操作会导致所配溶液浓度偏高的是________。
A.转移时有少量溶液溅出 | B.容量瓶用蒸馏水洗净后未干燥 |
C.定容时俯视读取刻度 | D.定容时液面超过了刻度线 |
E.称量NaCl时用了生锈的砝码
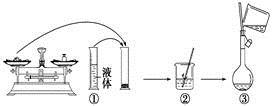
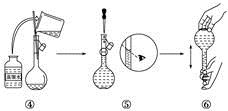
(9)下图是某同学在实验室配制该NaCl溶液的过程示意图,其中有错误的是_________(填操作序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HX | HY | HZ | |
| 浓度 mol•L-1 | 0.1 0.5 | 1.0 1.5 | 2.0 2.5 |
| 电离度 | 0.3% 0.13% | 0.3% 0.24% | 0.5% 0.45% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b>c>d | B. | b>a=d>c | C. | b>a>d>c | D. | c>a=d>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3是氧化剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 生成1mol Na2FeO4时,有3mol电子转移 | |
| D. | Na2FeO4能杀菌消毒是利用Na2FeO4中+6价铁的强还原性被还原为Fe3+,净水是利用Fe3+在水中产生Fe(OH)3胶体从而吸附水中的悬浮颗粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com