
| A、加入NaOH溶液后,溶液一定满足:c(H+)+c(Na+)═c(OH-)+c(C1-)+c(CH3COO-) |
| B、加入10 mLNaOH溶液时,溶液满足(溶液体积变化忽略不计):c(CH3COO-)+c(CH3COOH)=0.05 mol/L |
| C、加入15 mLNaOH溶液时,呈酸性,溶液满足:c(Na+)>c(C1-)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D、加入足量NaOH溶液时,溶液中发生的中和反应的热化学方程式表示为:H+(aq)+OH-(aq)═H2O(1)△H=一57.3 kJ?mol-1 |


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
A、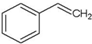 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 能使溴水褪色,但不能是酸性高锰酸钾溶液褪色 |
| B、乙烯能和溴水、酸性高锰酸钾溶液发生加成反应使之褪色 |
| C、气态烃CxHy与适量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),则 y=4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃中含碳的质量分数越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③④ |
| C、③⑤⑥ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和浓溴水用铁做催化剂制溴苯 |
| B、将苯与浓硝酸混合共热制硝基苯 |
| C、甲烷与氯气光照制得纯净的一氯甲烷 |
| D、乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:
X、Y、Z是三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素的常见单质在常温下都是无色气体,如图中的A、B、C分别表示三种单质两两反应的生成物:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
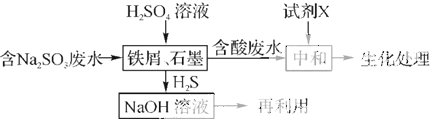
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com