
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是____,操作②的名称是____。
(2)试剂a是_____ (填化学式,下同),试剂b是_____。固体B是_____。
(3)加入试剂a所发生反应的化学方程式为__________。加入试剂b所发生反应的化学方程式为___________。
(4)该方案能否达到实验目的:______。(填“能”或“不能”)若不能,应如何改进?(若能,此问不用回答)_____。
【答案】溶解 过滤 K2CO3 HCl BaCl2 K2CO3+BaCl2=BaCO3↓+2KCl BaCO3+2HCl=BaCl2+CO2↑+H2O 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤得到的沉淀A(BaCO3)经洗涤后加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2;操作②所得滤液为KCl和过量K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,应加入过量盐酸除去过量K2CO3得KCl,以此解答该题。
(1)由上述分析过程操作①的名称是溶解,操作②为固液分离的操作,名称是过滤。
答案为:溶解;过滤。
(2) 由以上分析可知试剂a为K2CO3,试剂b是.HCl,固体B为BaCl2;
故答案为:K2CO3;HCl ;BaCl2。
(3)加入试剂K2CO3,与BaCl2反应生成碳酸钡和氯化钾,所发生反应的化学方程式为K2CO3+BaCl2=BaCO3↓+2KCl;加入试剂盐酸,与沉淀碳酸钡反应生成氯化钡、二氧化碳和水,所发生反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O。
答案为:K2CO3+BaCl2=BaCO3↓+2KCl;BaCO3+2HCl=BaCl2+CO2↑+H2O。
(4) 由于试剂K2CO3加入过量,操作②过滤后所得滤液为KCl和K2CO3的混合物,蒸发结晶得到固体C为KCl和K2CO3,所以不能达到实验目的;应在蒸发结晶前应加入过量稀盐酸,将过量的碳酸钾转化成氯化钾,否则晶体不纯。
答案为:不能;应在操作②的滤液中加入过量盐酸后再蒸发结晶。


科目:高中化学 来源: 题型:
【题目】G是一种药物的中间体,其合成的部分路线如下:
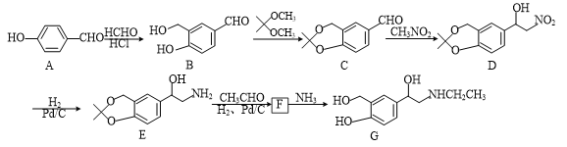
(1)C→D的反应类型是___反应。
(2)化合物F的分子式为C14H21NO3,写出F的结构简式:___。
(3)化合物A与HCHO反应还可能生成的副产物是___。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①分子中含有苯环,能与NaHCO3溶液反应;
②含有一个手性碳原子。
(5)根据已有知识并结合相关信息,写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是
A. 实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. 工业上合成氨反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0 选择500 ℃
2NH3(g) △H<0 选择500 ℃
C. H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D. SO2氧化成SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaF2、CaC2都是工业生产的重要物质。回答下列问题:
(1)基态钙原子的电子排布式___________,钙原子核外有___________种能量状态的电子。
(2)CaC2与水反应生成乙炔(C2H2),乙炔中碳原子的杂化类型为___________,乙炔中的σ键与π键数之比为___________。
(3)CaF2与浓H2SO4反应生成HF,HF的沸点高于C2H2,原因是:___________;HF能的BF3化合得到HBF4,从化学键形成角度分析HF与BF3能化合的原因___________。
(4)NO2F分子与BF3互为等电子体,则NO2F分子的立体构型为______________________。
(5)CaF2的晶胞为立方晶胞,结构如下图所示:

①CaF2晶胞中,Ca2+的配位数为___________个。
②“原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(___________,___________,![]() )
)
③晶胞中两个F-的最近距离为273.1pm,用NA表示阿伏加德罗常数,则晶胞的密度为___________g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物在生产生活中有广泛应用。回答下列问题:
(1)基态钴原子价电子排布式为___________。
(2)Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为___________。
(3)[Co(NO3-)4]2-中Co2+的配位数为4,配体中N的杂化方式为___________,该配离子中各元素I1由小到大的顺序为___________(填元素符号),1mol该配离子中含σ键数目为___________NA。
(4)八面体配合物CoCl3·3NH3结构有___________种,其中极性分子有___________种。
(5)配合物Co2(CO)8的结构如下图,该配合物中存在的作用力类型有___________(填标号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力

(6)钴蓝晶体结构如下图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___________,晶体中Al3+占据O2-形成的___________(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为___________g·cm-3(列计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中正确的是( )
A. 中所有碳原子可能在同一平面上
中所有碳原子可能在同一平面上
B.CH3CH2CHClCH3的命名为2-甲基-1-氯丙烷
C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.C4H8属于烯烃的同分异构体共有4种(含顺反异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乳酸的结构简式为:

(1)则90g乳酸与足量金属钠反应产生的气体在标准状况下的体积是_____________L,方程式为______________________________________________________
(2)乳酸发生消去反应的条件__________;生成有机物的结构简式_____________。
(3)已知两分子乳酸可在一定条件下反应生成环状的酯,写出该酯的结构简式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是 ( )
A. 该有机物的分子式为C4H4B. 该有机物不存在
C. 该有机物的空间构型为正四面体D. 该有机物不属于苯的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com