
| 组别 | 10%硫酸溶液的体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | 无 |
| Ⅱ | 2mL | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2mL | 30 | 无 |
| Ⅳ | 1mL | 20 | 1mL蒸馏水 |
分析 (1)研究催化剂对反应速率的影响,需要其他条件相同;研究温度变化需要改变温度探究反应速率变化;
(2)对比实验I和IV,硫酸体积不同,探究氢离子浓度对反应速率的影响,加入1ml水的目的是保持溶液总体积不变,改变硫酸溶液中氢离子浓度;
(3)②高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管;
③根据滴定管的结构、精确度以及测量原理来解答;根据关系式KMnO4~5Na2C2O4来计算.
解答 解:(1)研究催化剂对反应速率的影响,需要其他条件相同;实验I和II 的实验中,Ⅱ中加入硫酸锰是验证催化剂对反应速率的影响;研究温度变化需要改变温度探究反应速率变化,选择实验I和III,
故答案为:I;II; I;III;
(2)对比实验I和IV,硫酸体积不同,探究氢离子浓度对反应速率的影响,加入1ml水的目的是保持溶液总体积不变,改变硫酸溶液中氢离子浓度,
故答案为:c(H+)(或硫酸溶液的浓度);确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变;
(3)②高锰酸钾具有强氧化性,能腐蚀碱式滴定管的橡皮管,应装在酸式滴定管中,
故答案为:酸式;
③酸性KMnO4消耗了40mL;KMnO4溶液的物质的量浓度为c,WgNa2C2O4配成100mL标准溶液,
2KMnO4 ~5Na2C2O4
2 5×134g
0.04L×c W g
$\frac{2}{0.04L×c}$=$\frac{5×134}{W}$,
解得:c=$\frac{W}{13.4}$ mol•L-1,
故答案为:$\frac{W}{13.4}$ mol•L-1.
点评 本题考查了条件不同对反应速率影响的分析判断,主要是催化剂、温度、浓度对反应速率的影响探究,注意氧化还原反应的原理和计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 亚磷酸H3PO3只有Na2HPO3、NaH2PO3两种钠盐,所以亚磷酸没有正盐 | |
| B. | 同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强 | |
| C. | 配位键也有方向性和饱和性 | |
| D. | H3PO4和H2CO3分子中非羟基氧的个数均为1,他们的酸性相近,均为中强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
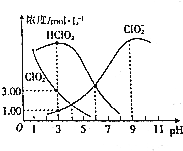 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | HClO2的电离平衡常数Ka=10-6 | |
| C. | pH=3时,c(Cl-)>c(ClO2-) | |
| D. | pH=4时,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
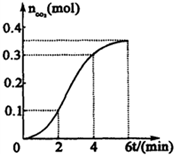 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 微粒代码 | a | b | c | d | e | f | g | h |
| 原子核数目 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 | 多核 |
| 带电荷数 (单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 | 0 |
| A. | b对应元素的最高价氧化物的水化物的碱性比e强 | |
| B. | d的水溶液显碱性 | |
| C. | H具有可燃性 | |
| D. | e相应的元素的单质与g微粒任何条件下都不能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
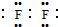 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

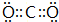 ,其中②原子的杂化方式为sp.
,其中②原子的杂化方式为sp. ,⑪原子的价电子排布式是4s24p3
,⑪原子的价电子排布式是4s24p3查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com