
【题目】(1)SO2和NOx都是大气污染物。采取还原法,用炭粉可将氮氧化物还原。
已知:N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g) ΔH=________kJ·mol-1。
(2)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被NH4HSO3溶液吸收的离子方程式是_____________________________。
(3)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式:____________。
(4)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______。
(5)在一定条件下,可逆反应:mA+nBpC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n__p。(填< > =)
②A、C是气体,增加B的量,平衡不移动,则B为______态。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___
④加热后,可使C的质量增加,则正反应是_____反应(填“放热”或“吸热”)
【答案】-574.1 2NO2+4HSO3- = N2+4SO42-+4H+ C4H10(g) +![]() O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ/mol; 1:1 < 固或液 逆反应方向 吸热
O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ/mol; 1:1 < 固或液 逆反应方向 吸热
【解析】
(1)① N2(g)+O2(g) = 2NO(g) ΔH=+180.6 kJ·mol-1②C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1,根据盖斯定律②-①得C(s)+2NO(g) = CO2(g)+N2(g)ΔH=-574.1kJ·mol-1 ;故答案为:-574.1;
(2)NO2被吸收的反应物为NO2、NH4HSO3,二氧化氮中氮元素为+4价,生成物有氮气,所以亚硫酸氢根离子中硫被氧化成硫酸根离子,反应为2NO2+4HSO3-=N2+4SO42-+4H+,故答案为:2NO2+4HSO3-=N2+4SO42-+4H+;
(3)丁烷化学式是C4H10,相对分子质量是58,则10kg丁烷的物质的量是n(C4H10)= 10000g÷ 58g/mol=172.4mol,其完全燃烧生成二氧化碳和液态水时,放出的热量为5×105kJ,则单位物质的量的丁烷完全燃烧放出热量是5×105kJ÷172.4mol=2900kJ/mol,所以丁烷燃烧热的热化学方程式是C4H10(g) +![]() O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ/mol;
O2(g)=4CO2(g)+5H2O(l) △H=-2900kJ/mol;
(4)假设在混合物中含有C、H2的物质的量分别是x、y,则x+y=0.2mol;393.5kJ/molx+(483.6kJ/mol÷2)y=63.53kJ,解得x=0.1mol,y=0.1mol,所以混合物中C与H2的物质的量之比为1:1,故答案为:1:1;
(5)①因减小压强,平衡向气体体积增大的方向移动,所以m+n<p,故答案为:<;
②增加B的量,平衡不移动,说明B的浓度不变,B可以是液体也可以是固体,故答案为:固或液;
③因增大压强,平衡向气体体积减小的方向移动,A、C是气体,而且m+n=p,所以B不是气体,则m<p,即平衡移动的方向是逆反应方向,故答案为:逆反应方向;
④因温度升高,平衡向吸热的方向移动,C的质量增加,说明正反应是吸热反应,故答案为:吸热。


科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。

(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol。NO分子中化学键的键能为__________________kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:________________。
(5)已知Na2SO4·10H2O![]() Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
B. 工业上用Cl2与石灰乳反应制取漂白粉,每反应1molCl2则转移电子数为NA
C. 在1 mol乙烷与乙烯的混合气体中,氢原子数为5NA
D. 0.3mol·L-1的CuSO4溶液中含有SO![]() 的数目为0.3NA
的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究某带结晶水的晶体X(仅含4种元素)的组成和性质,设计并完成了如下实验,其中甲、乙、丙均为常见物质。

请回答:(1)X中除H、O以外的非金属元素是______。
(2)固体乙与氨气在加热条件下反应也能得到单质丙,同时产生空气中含量最高的气体,写出该反应的化学方程式 ______。
(3)X的化学式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扑热息痛是一种优良的解热镇痛剂,其结构简式为 ,以下对它的叙述中错误的是( )
,以下对它的叙述中错误的是( )
A. 能与烧碱溶液反应
B. 能与浓溴水发生取代反应
C. 能发生水解反应
D. 能发生加聚反应形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(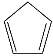 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知:![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol 1 ①
H2(g)+ I2(g) =2HI(g) ΔH2=11.0 kJ·mol 1 ②
对于反应:![]() (g)+ I2(g) =
(g)+ I2(g) =![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)互为同分异构体的不同物质相对分子质量相等,相对分子质量相等的不同物质一定互为同分异构____。
(2)氰酸(H—O—C≡N)和雷酸(H—N==C==O)都是无机物,它们互为同分异构体____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com